Оценка эффективности эзофагопротекции в прикрытии коротких периодов отмены поддерживающей терапии ингибиторами протонной помпы (ИПП) у пациентов с пищеводом Барретта (ПБ)
Цель. Оценка эффективности эзофагопротекции в прикрытии коротких периодов отмены поддерживающей терапии ингибиторами протонной помпы (ИПП) у пациентов с пищеводом Барретта (ПБ).
Материалы и методы. Проведен ретроспективный анализ данных пациентов с гистологически верифицированным ПБ, получавших амбулаторно терапию ИПП не менее 12 мес. Сформированная когорта была разделена на две группы для последующего сравнения в зависимости от режима терапии, которую получали пациенты. Первая группа формировалась только из лиц, постоянно принимающих ИПП, тогда как вторая группа — из пациентов, у которых были периодические перерывы в приеме ИПП. Во второй группе анализу подлежали только случаи, где в качестве прикрытия периодов отмены ИПП пациентами использовался эзофагопротектор Альфазокс (10 мл 4 раза в день, после каждого приема еды и на ночь). В когорте анализировались демографические данные (возраст, пол), факторы риска, длина сегмента ПБ, степень дисплазии, частота рецидивов эрозивного эзофагита, результаты манометрии высокого разрешения по двигательным нарушениям грудного отдела пищевода (неэффективная моторика и отсутствие сократимости).
Результаты. В исследование были включены 39 пациентов (28 мужчин и 11 женщин) с гистологически верифицированным ПБ. Средний возраст обследованных составил 57,1538 года (95% доверительный интервал 53,4269–60,8808). В гендерной структуре преобладали мужчины (n=28). Длительность анамнеза по ПБ в анализируемой когорте составила 5,6769 года (95% доверительный интервал 4,6161–6,7378). Первую группу составили 23 пациента, получающие ИПП постоянно. Вторая группа была сформирована из 16 больных, у которых были периодические перерывы в приеме ИПП, которые прикрывались эзофагопротектором Альфазокс. В проанализированной когорте не было выявлено достоверных различий между группами по средней длине сегмента ПБ, числу пациентов с длинным сегментом ПБ, степени дисплазии, количеству рецидивов эрозивного эзофагита и частоте двигательных нарушений грудного отдела пищевода.
Заключение. В рутинной практике существуют причины, требующие временного прекращения приема ИПП у пациентов с ПБ, что требует введения курсовой эзофагопротекции для прикрытия рисков. Результаты настоящего ретроспективного сравнительного исследования свидетельствуют об эффективности данной стратегии.
Пищевод Барретта (ПБ) — это предраковое патологическое состояние, возникающее в результате замещения многослойного плоского неороговевающего эпителия специализированным железистым эпителием кишечного типа в слизистой оболочке дистального отдела пищевода, выявляемое при эндоскопическом исследовании и подтвержденное наличием кишечной метаплазии при гистологическом исследовании биоптатов [1, 2]. ПБ является осложнением гастроэзофагеальной рефлюксной болезни (ГЭРБ), которая представляет собой чрезвычайно распространенное в мировой популяции кислотозависимое заболевание, при котором соляная кислота желудочного сока выступает основным повреждающим фактором при развитии клинических симптомов и морфологических проявлений [3, 4]. В ранней метааналитической работе J. Taylor и соавт. (2010 г.) было продемонстрировано, что ГЭРБ значительно ассоциирована с развитием ПБ (отношение шансов — ОШ 2,90, 95% доверительный интервал — ДИ 1,86–4,54) [5]. Согласно недавнему метаанализу L. Eusebi и соавт. (2021 г.), обобщившему результаты 44 исследований, частота гистологически верифицированного ПБ у пациентов с ГЭРБ составляет 7,2% (95% ДИ 5,4–9,3%), тогда как эндоскопические признаки ПБ выявляются у 12,0% больных (95% ДИ 5,5–20,3%) [6]. Доказанными факторами риска ПБ являются европеоидная раса, мужской пол, табакокурение, абдоминальное ожирение [7–10]. Клинико-социальная значимость ПБ определяется риском развития аденокарциномы пищевода, характеризующейся крайне неблагоприятным прогнозом и высокой летальностью [11].
Риск прогрессирования ПБ в аденокарциному пищевода зависит от наличия диспластических изменений слизистой оболочки [2, 4, 11]. Так, у пациентов без дисплазии данный риск составляет 0,3 случая на 100 человеко-лет, при дисплазии низкой степени — 0,5 на 100 человеко-лет, тогда как при дисплазии высокой степени — 6,6 на 100 человеко-лет [12]. Наличие дисплазии легкой степени ассоциировано с 4-кратным увеличением риска прогрессирования ПБ в дисплазию высокой степени и аденокарциному пищевода (ОШ 4,25, 95% ДИ 2,58–7,0) [13]. Согласно современным российским и зарубежным клиническим рекомендациям, базисом фармакотерапии ПБ являются ингибиторы протонной помпы (ИПП), применение которых способствует редукции кумулятивного риска развития неопластических изменений у пациентов на стадии метаплазии при длительном применении этих препаратов [3, 14, 15]. Метаанализ R. Krishnamoorthi и соавт. (2018 г.) показал, что использование ИПП достоверно снижает риск прогрессии ПБ (ОШ 0,55; 95% ДИ 0,32–0,96) [13]. Недавний метаанализ Y. Chen и соавт. (2021 г.), обобщивший результаты 12 исследований (n=155 769), продемонстрировал, что применение ИПП ассоциировано со значительным снижением риска прогрессирования ПБ до дисплазии высокой степени/аденокарциномы пищевода (ОШ 0,47, 95% ДИ 0,32–0,71) [16].
Наличие гистологически верифицированного ПБ требует пожизненной терапии ИПП. Вместе с тем в клинической практике нередко бывают ситуации, требующие временной (от 1 нед до около месяца) отмены ИПП для валидного проведения ряда диагностических мероприятий [4, 17]. Помимо этого, длительный прием ИПП может приводить к некоторым нежелательным последствиям в долгосрочной перспективе. Метаанализ W. Lo и соавт. (2012 г.), обобщивший результаты 11 исследований (n=3134), продемонстрировал, что у пациентов, регулярно принимающих ИПП, повышается риск развития синдрома избыточного бактериального роста (СИБР) в тонкой кишке с ОШ 2,282 (95% ДИ 1,238–4,205) [18]. Эти данные были подтверждены более поздней метааналитической работой T. Su и соавт. (2018 г.), объединившей результаты 19 исследований (n=7055), которая также выявила значимую ассоциацию между длительным приемом ИПП и СИБР (ОШ 1,71; 95% ДИ 1,20–2,43) [19]. В настоящий момент СИБР рассматривается как возможный патогенетический механизм в формировании ряда заболеваний, ассоциированных с изменениями моторики желудочно-кишечного тракта, а также альтерацией качественного и количественного состава микрофлоры кишечника, что в совокупности может приводить к развитию кишечных симптомов и метеоризма [20, 21]. Последние метаанализы демонстрируют, что СИБР достаточно часто ассоциирован с синдромом раздраженного кишечника, с обобщенной частотой от 35,5 до 38% [22, 23]. Недавнее крупное многоцентровое исследование, выполненное в Мексике, c участием более 1800 больных, продемонстрировало, что у пациентов, получающих ИПП, достаточно часто выявляются клинические признаки, характерные для СРК [20].
Таблица 1. Причины прерывистого приема ИПП у пациентов 2-й группы

Таблица 2. Демографическая и клиническая характеристика пациентов в группах
Недавнее проспективное сравнительное исследование нашей группы показало, что использование эзофагопротектора Альфазокс способствует снижению риска рецидива симптомов рефлюкса у пациентов, требующих временную отмену терапии ИПП [17]. Исходя из изложенного, видится целесообразным оценить влияние коротких перерывов в поддерживающей терапии ИПП у пациентов с ПБ, используя прикрытие эзофагопротектором периодов отмены.
Цель настоящего ретроспективного сравнительного исследования — оценка эффективности эзофагопротекции в прикрытии коротких периодов отмены поддерживающей терапии ИПП у пациентов с ПБ.
В исследование были включены 39 пациентов (28 мужчин и 11 женщин) с гистологически верифицированным ПБ. Средний возраст обследованных составил 57,1538 года (95% ДИ 53,4269–60,8808). В гендерной структуре преобладали мужчины (n=28). Длительность анамнеза по ПБ в анализируемой когорте составила 5,6769 года (95% ДИ 4,6161–6,7378).
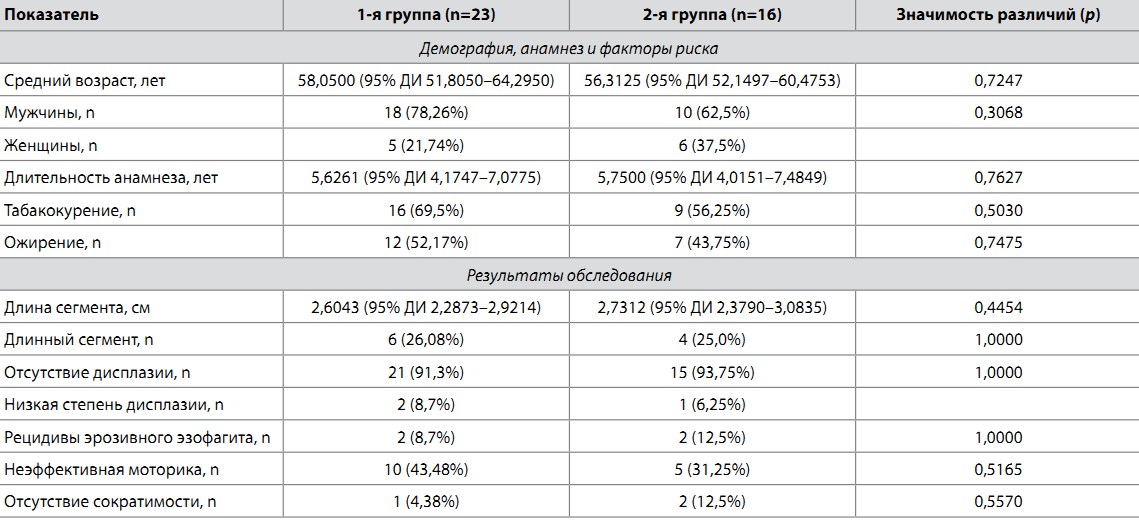
Ретроспективный анализ данных медицинской документации продемонстрировал, что на момент постановки диагноза ПБ обе сформированные группы достоверно не различались по возрасту (p=0,7451), гендерному составу (p=0,3068), наличию длинного сегмента ПБ (p=1,0000) и низкой степени дисплазии (p=1,0000).
Обобщенная длительность периода наблюдения в исследуемой когорте составила 17,5 мес. Результаты итогового сопоставления обеих групп по демографическим, анамнестическим и клиническим характеристикам представлены в табл. 2. В проанализированной когорте не было выявлено достоверных различий между группами по средней длине сегмента ПБ, числу пациентов с длинным сегментом ПБ, степени дисплазии, количеству рецидивов эрозивного эзофагита и частоте двигательных нарушений грудного отдела пищевода. С момента постановки диагноза ни в одной из групп не было выявлено прогрессирования ПБ в дисплазию высокой степени или аденокарциному пищевода.
ПБ — это предраковое состояние, обуславливающее повышенный риск развития аденокарциномы пищевода путем последовательного перехода от метапластического эпителия без дисплазии к дисплазии низкой и высокой степени и в конечном итоге к раку [1, 4]. На сегодняшний день доказано, что постоянная терапия с применением ИПП способствует редукции кумулятивного риска развития неопластических изменений у пациентов с ПБ [3, 14–16]. Вместе с тем в рутинной клинической практике нередко бывают ситуации, требующие временной (от 1 нед до около месяца) отмены ИПП для валидного проведения ряда диагностических мероприятий и ряд других причин [17, 24].
Данная диспозиция требует от клинициста прикрытия рисков прогрессирования ПБ. Использование антацидных препаратов на время отмены ИПП малоэффективно ввиду выраженной краткосрочности их действия [17, 25]. Учитывая, что в прогрессии ПБ играет роль не только соляная кислота, но и компоненты желчи, поступающие в дистальный отдел пищевода дуоденогастроэзофагеальным рефлюксом, перспективным представляется оценка эффективности эзофагопротекторов для прикрытия указанных рисков [26, 27]. Эзофагопротекторы — это новая фармакологическая группа, представителем которой является биоадгезивная формула на основе гиалуроновой кислоты и хондроитина сульфата (Альфазокс), созданная для защиты слизистой оболочки пищевода [27, 28]. Настоящее ретроспективное сравнительное исследование, цель которого — оценка эффективности эзофагопротекции в прикрытии коротких периодов отмены поддерживающей терапии ИПП у пациентов с ПБ, продемонстрировало, что в проанализированной когорте не выявлено достоверных различий между группами постоянно принимавших ИПП и прерывисто, прикрываясь эзофагопротекцией, по средней длине сегмента ПБ, числу пациентов с длинным сегментом ПБ, степени дисплазии, количеству рецидивов эрозивного эзофагита и частоте двигательных нарушений грудного отдела пищевода. Представляется, что такая эффективность обусловлена механизмом действия Альфазокса, который оказывает заживляющее и восстанавливающее действие по отношению к эпителию пищевода, а благодаря высокой способности к биоадгезии обеспечивает защиту слизистой оболочки органа в течение длительного времени, снижая вероятность контакта соляной кислоты с эпителиоцитами, необходимую для индукции симптоматики заболевания [27]. Согласно клиническим исследованиям Альфазокс способствует заживлению эрозий пищевода, в том числе в сочетании с ИПП у пациентов с ГЭРБ [29–31].
Таким образом, в рутинной практике существуют причины, требующие временного прекращения приема ИПП у пациентов с ПБ, что требует введения курсовой эзофагопротекции для прикрытия рисков. Результаты настоящего ретроспективного сравнительного исследования свидетельствуют об эффективности данной стратегии. Несмотря на полученные оптимистичные данные, следует признать необходимость проведения проспективных исследований с более длительным периодом наблюдения.
1. Зайратьянц О.В., Маев И.В., Смольянникова В.А., Мовтаева П.Р. Патологическая анатомия пищевода Баррета. Архив патологии. 2011;73(3):21-6 [Zairat’iants OV, Maev IV, Smol’iannikova VA, Movtaeva PR. Patologicheskaia anatomiia pishchevoda Barreta. Arkhiv patologii. 2011;73(3):21-6 (in Russian)].
2. Tanţău M, Laszlo M, Tanţău A. Barrett’s Esophagus — State of the Art. Chirurgia (Bucur). 2018;113(1):46-60. DOI:10.21614/chirurgia.113.1.46
3. Ивашкин В.Т., Маев И.В., Трухманов А.С., и др. Рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению гастроэзофагеальной рефлюксной болезни. Рос. журн. гастроэнтерологии, гепатологии, колопроктологии. 2020;30(4):70-97 [Ivashkin VT, Maev IV, Trukhmanov AS, et al. Rekomendatsii Rossiiskoi gastroenterologicheskoi assotsiatsii po diagnostike i lecheniiu gastroezofageal’noi refliuksnoi bolezni. Ros. zhurn. gastroenterologii, gepatologii, koloproktologii. 2020;30(4):70-97 (in Russian)]. DOI:10.22416/1382-4376-2020-30-4-70-97
4. Маев И.В., Бусарова Г.А., Андреев Д.Н. Болезни пищевода. М.: ГЭОТАР-Медиа, 2019. [Maev IV, Busarova GA, Andreev DN. Diseases of the esophagus. Moscow: GEOTAR-Media, 2019 (in Russian)].
5. Taylor JB, Rubenstein JH. Meta-analyses of the effect of symptoms of gastroesophageal reflux on the risk of Barrett’s esophagus. Am J Gastroenterol. 2010;105(8):1729,1730-7;quiz 1738. DOI:10.1038/ajg.2010.194
6. Eusebi LH, Cirota GG, Za gari RM, Ford AC. Global prevalence of Barrett’s oesophagus and oesophageal cancer in individuals with gastro-oesophageal reflux: a systematic review and metaanalysis. Gut. 2021;70(3):456-63. DOI: 10.1136/gutjnl-2020-321365
7. Mohy-Ud-Din N, Krill TS, Shah AR, et al. Barrett’s esophagus: What do we need to know? Dis Mon. 2019 Feb 23. DOI:10.1016/j.disamonth.2019.02.003
8. ASGE standards of practice committee, Qumseya B, Sultan S, Bain P, et al; ASGE Standards of Practice Committee Chair. ASGE guideline on screening and surveillance of Barrett’s esophagus. Gastrointest Endosc. 2019;90(3):335-59.e2. DOI: 10.1016/j.gie.2019.05.012
9. Qumseya BJ, Bukannan A, Gendy S, et al. Systematic review and meta-analysis of prevalence and risk
factors for Barrett’s esophagus. Gastrointest Endosc. 2019;90(5):707-717.e1. DOI:10.1016/j.gie.2019.05.030
10. Маев И.В., Кучерявый Ю.А., Андреев Д.Н. Ожирение и коморбидность. М., 2016 [Maev IV,
Kucheryavyy YuA, Andreev DN. Obesity and comorbidity. Moscow, 2016 (in Russian)].
11. Маев И.В., Андреев Д.Н., Кучерявый Ю.А., Щегланова М.П. Аденокарцинома пищевода: факторы риска и современные стратегии скрининга. Рос. журн. гастроэнтерологии, гепатологии, колопроктологии. 2017;27(2):4-12 [Maev IV, Andreev DN, Kucheriavyi IuA, Shcheglanova MP. Adenokartsinoma pishchevoda: faktory riska i sovremennye strategii skrininga. Ros. zhurn. gastroenterologii, gepatologii, koloproktologii. 2017;27(2):4-12 (in Russian)]. DOI:10.22416/1382-4376-2017-27-2-4-12
12. Krishnamoorthi R, Mohan BP, Jayaraj M, et al. Risk of progression in Barrett’s esophagus indefinite for dysplasia: a systematic review and meta-analysis. Gastrointest Endosc. 2020;91(1):3-10.e3.
DOI:10.1016/j.gie.2019.07.037
13. Krishnamoorthi R, Singh S, Ragunathan K, et al. Factors Associated With Progression of Barrett’s Esophagus: A Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol. 2018;16(7):1046-1055.e8. DOI:10.1016/j.cgh.2017.11.044
14. Fitzgerald RC, di Pietro M, Ragunath K, et al; British Society of Gastroenterology. British Society of Gastroenterology guidelines on the diagnosis and management of Barrett’s oesophagus. Gut. 2014;63(1):7-42. DOI:10.1136/gutjnl-2013-305372
15. Shaheen NJ, Falk GW, Iyer PG, Gerson LB; American College of Gastroenterology. ACG Clinical Guideline: Diagnosis and Management of Barrett’s Esophagus. Am J Gastroenterol. 2016;111(1):30-50; quiz 51. DOI:10.1038/ajg.2015.322
16. Chen Y, Sun C, Wu Y, et al. Do proton pump inhibitors prevent Barrett’s esophagus progression to high-grade dysplasia and esophageal adenocarcinoma? An updated meta-analysis. J Cancer Res Clin Oncol. 2021 Feb 11. DOI:10.1007/s00432-021-03544-3
17. Кучерявый Ю.А., Мовтаева П.Р., Андреев Д.Н., и др. Снижение риска рецидива симптоматики при применении эзофагопротектора у пациентов, требующих временную отмену антисекреторной терапии. Эффективная фармакотерапия. 2021 [Kucheriavyi IuA, Movtaeva PR, Andreev DN, et al. Snizhenie riska retsidiva simptomatiki pri primenenii ezofagoprotektora u patsientov, trebuiushchikh vremennuiu otmenu antisekretornoi terapii. Effektivnaia farmakoterapiia. 2021 (in Russian)].
18. Lo WK, Chan WW. Proton pump inhibitor use and the risk of small intestinal bacterial overgrowth: a meta-analysis. Clin Gastroenterol Hepatol. 2013;11(5):483-90. DOI:10.1016/j.cgh.2012.12.011
19. Su T, Lai S, Lee A, et al. Meta-analysis: proton pump inhibitors moderately increase the risk of small intestinal bacterial overgrowth. J Gastroenterol. 2018;53(1):27-36. DOI:10.1007/s00535-017-1371-9
20. Schmulson MJ, Frati-Munari AC. Bowel symptoms in patients that receive proton pump inhibitors. Results of a multicenter survey in Mexico. Rev Gastroenterol Mex. 2019;84(1):44-51. DOI:10.1016/j.rgmx.2018.02.008
21. Losurdo G, Salvatore D’Abramo F, Indellicati G, et al. The Influence of Small Intestinal Bacterial Overgrowth in Digestive and Extra-Intestinal Disorders. Int J Mol Sci. 2020;21(10):3531. DOI:10.3390/ijms21103531
22. Shah A, Talley NJ, Jones M, et al. Small Intestinal Bacterial Overgrowth in Irritable Bowel Syndrome: A Systematic Review and Meta-Analysis of Case-Control Studies. Am J Gastroenterol. 2020;115(2):190-201. DOI:10.14309/ajg.0000000000000504
23. Chen B, Kim JJ, Zhang Y, et al. Prevalence and predictors of small intestinal bacterial overgrowth in irritable bowel syndrome: a systematic review and meta-analysis. J Gastroenterol. 2018;53(7):807-18. DOI:10.1007/s00535-018-1476-9
24. Тактика врача-гастроэнтеролога. Практическое руководство. Под ред. И.В. Маева. М., 2021 [Tactics of a gastroenterologist. A practical guide. Ed. IV Maev. Moscow, 2021 (in Russian)].
25. Маев И.В., Самсонов А.А., Андреев Д.Н. Роль и место антацидов в современных алгоритмах терапии кислотозависимых заболеваний. Фарматека. 2013;2(255):65-72 [Maev IV, Samsonov AA, Andreev DN. Rol’ i mesto antatsidov v sovremennykh algoritmakh terapii kislotozavisimykh zabolevanii. Farmateka. 2013;2(255):65-72 (in Russian)].
26. Маев И.В., Гуленченко Ю.С., Андреев Д.Н., и др. Дуоденогастроэзофагеальный рефлюкс: клиническое значение и подходы к терапии. Consilium Medicum. 2014;16(8):5-8 [Maev IV, Gulenchenko IuS, Andreev DN, et al. Duodenogastroezofageal’nyi refliuks: klinicheskoe znachenie i podkhody k terapii. Consilium Medicum. 2014;16(8):5-8 (in Russian)].
27. Маев И.В., Андреев Д.Н., Кучерявый Ю.А., Шабуров Р.И. Современные достижения в лечении гастроэзофагеальной рефлюксной болезни: фокус на эзофагопротекцию. Терапевтический архив. 2019;91(8):4-11 [Maev IV, Andreev DN, Kucheryavyy YuA, Shaburov RI. Current advances in the treatment of gastroesophageal reflux disease: a focus on esophageal protection. Terapevticheskii Arkhiv (in Russian)]. DOI:10.26442/00403660.2019.08.000387
28. Эмбутниекс Ю.В., Валитова Э.Р., Бордин Д.С. Новый подход к лечению гастроэзофагеальной рефлюксной болезни: защита слизистой оболочки пищевода. Эффективная фармакотерапия. 2019;15(18):16-22 [Embutnieks IuV, Valitova ER, Bordin DS. Novyi podkhod k lecheniiu gastroezofageal’noi refliuksnoi bolezni: zashchita slizistoi obolochki pishchevoda. Effektivnaia farmakoterapiia. 2019;15(18):16-22 (in Russian)]. DOI:10.33978/2307-3586-2019-15-18-16-22
29. Palmieri B, Corbascio D, Capone S, Lodi D. Preliminary clinical experience with a new natural compound in the treatment of esophagitis and gastritis: symptomatic effect. Trends Med. 2009;9:219-25.
30. Palmieri B, Merighi A, Corbascio D, et al. Fixed combination of hyaluronic acid and chondroitinsulphate oral formulation in a randomized double blind, placebo controlled study for the treatment of symptoms in patients with non-erosive gastroesophageal reflux. Eur Rev Med Pharmacol Sci. 2013;17:3272-8.
31. Savarino V, Pace F, Scarpignato C. Esoxx Study Group Randomised clinical trial: mucosal protection combined with acid suppression in the treatment of non-erosive reflux disease — efficacy of Esoxx, a hyaluronic acid-chondroitin sulphate based bioadhesive formulation. Aliment Pharmacol Ther. 2017;45:631-42.







