О роли гастроэзофагеальной рефлюксной болезни (ГЭРБ) в генезе различной ЛОР-патологии говорили периодически, но интерес к этой проблеме особенно возрос с повышением качества диагностики (эндоскопические методы обследования) и доступностью этих методик для широкого круга врачей и пациентов, особенно в амбулаторной практике.
Сошлемся на данные исследования [1], согласно которому упоминание проблемы ГЭРБ в медицинской литературе существенно возрастает после 1982 г. (рис. 1), в том числе и в работах оториноларингологов (рис. 2).
Авторы данной публикации [1] даже используют собирательный термин «гастроэзофаго-фаринго-ларингеальная рефлюксная болезнь», подчеркивая множество проявлений, связанный с гастроэзофагеальным рефлюксом (ГЭР). Поэтому мы решили проанализировать работы, опубликованные начиная с 2005 г., посвященные роли рефлюкса в развитии различной ЛОР-патологии у детей и взрослых.
Начнем с терминологии. В табл. 1 представлены определения ГЭРБ согласно документации двух профессиональных сообществ: Союза педиатров России [2] и Российской гастроэнтерологической ассоциации (РГА) по диагностике и лечению ГЭРБ [3].
Согласно Федеральным клиническим рекомендациям по диагностике и лечению ГЭРБ у детей [2] выделяют внепищеводные синдромы ГЭРБ, причем для ряда из них связь с ГЭРБ установлена (рефлюкс-кашель, рефлюкс-ларингит, рефлюкс-астма, рефлюксиндуцированное разрушение зубной эмали), а для других нет (фарингит, синусит, аденоидит, рецидивирующий средний отит — РСО). Оба документа выделяют и конкретно «оториноларингологические» проявления ГЭРБ (табл. 2).
Рис. 1. Динамика публикаций по проблеме ГЭРБ.
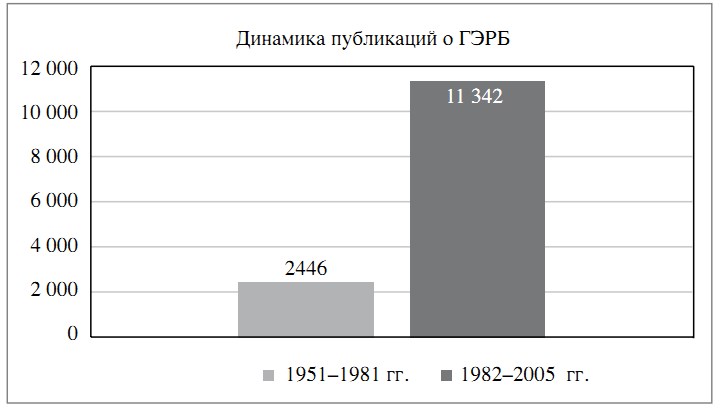
Рис. 2. Публикации оториноларингологов по проблеме ГЭРБ.
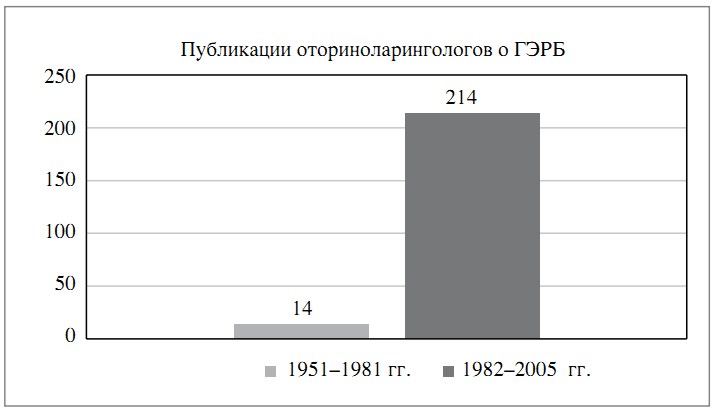
Таблица 1. Определения ГЭРБ согласно документации профессиональных сообществ

Таблица 2. Оториноларингологические проявления ГЭРБ [2, 3]

Данная симптоматика может встречаться при заболеваниях и гортани, и среднего уха, и околоносовых пазух, и различных отделов глотки, т.е. охватывает практически все ЛОР-органы. Вопросы ассоциированной с ГЭРБ патологии ЛОР-органов обсуждались неоднократно, причем фокус исследователей не просто концентрировался на определенной ЛОР-патологии, но и смещался от одной локализации к другой. Так, на состоявшемся в 2018 г. конгрессе детских гастроэнтерологов с международным участием в частности озвучено, что проблемы рефлюкс-ларингита уступают место изучению связи ГЭРБ с различными формами среднего отита.
Остановимся еще на одном практически важном аспекте. В литературе встречаются термины «экстраэзофагальный», «фарингеальный», «гастрофарингеальный», «фаринголарингеальный» или «ларингофарингеальный» рефлюкс (ЛФР). Согласно определению, данному в монографии «Рефлюкс-ларингит и связанные с этим состояния» [4], ларингофарингеальный рефлюкс (как наиболее часто употребимое понятие) — это ГЭРБ, поражающая гортань и глотку, причем ряд авторов — оториноларингологов предпочитают использовать именно этот термин.
Но остановимся более подробно на публикациях, посвященных связи ГЭРБ и патологии ЛОР-органов. Большинство из них посвящено влиянию ГЭРБ на частоту и структуру патологии гортани. Описываются частота ЛФР (18,4%) и проявления его: чувство «комка» в горле (97,5%), охриплость (88,1%), избыточное желание прочистить горло (83%) [5]. Ряд работ оценивали роль ЛФР у пациентов с полипами/лейкоплакией голосовых складок и карциномой гортани и сделали вывод, что чаще ЛФР встречается у пациентов с полипами и лейкоплакией голосовых складок [6]. Частота выявления ГЭРБ у пациентов с дисфонией составляет от 50 [7] до 63–69% [8,9], а с узелками голосовых складок — от 26 до 28% [8, 9]. Часто и детально описываются эндоскопические признаки ГЭРБ: эритема и отек межчерпаловидного пространства и задних отделов черпало-надгортанных и голосовых складок и подскладкового отдела [8–10], а вот на данные акустического анализа голоса призывают не полагаться, так как они неспецифичны [11]. Но есть работы, подчеркивающие низкую специфичность данных эндоскопического обследования гортани [12–14] и напоминающие о необходимости подтверждения диагноза ГЭРБ углубленными исследованиями, в частности проведения суточного рН-мониторирования. Высокую частоту ЛФР отмечали и оториноларингологи, работавшие с пациентами с отеком Гайека—Рейнке (100% vs 58% у контрольной группы, куда вошли пациенты с лейкоплакией и ранними стадиями рака гортани) [15].
Несмотря на то что, согласно Федеральным клиническим рекомендациям по диагностике и лечению ГЭРБ у детей Союза педиатров России, воспалительная патология глотки не относится к числу заболеваний с подтвержденной связью с ГЭРБ, тем не менее мы нашли целый ряд работ, эту связь подтверждающих [16–18]. Подчеркивается важность индивидуального подхода к пациентам с рефлюкс-фарингитом и назофарингитом [16], обсуждается добавление к стандартной терапии антирефлюксных лекарственных средств [17] у пациентов с хроническим неспецифическим фарингитом (ХНФ) как подтверждение точки зрения, что ЛФР один из предрасполагающих факторов к его развитию [17, 18].
Нами найдена серия работ, посвященных роли Helicobacter pylori в генезе воспалительных заболеваний глотки [19–21]. Одна из них [19] выявила отсутствие превалирования H. pylori у пациентов с хронической или рецидивирующей инфекцией небных миндалин, что позволило авторам сделать вывод об отсутствии очевидных доказательств роли H. pylori в генезе в частности хронического тонзиллита (ХТ). В другом исследовании [20] также проводилось определение H. pylori в тканях небных миндалин (материал, полученный при тонзиллотомии/эктомии), показано, что частота выделения H. pylori в общей выборке (дети и взрослые) довольно высока: 56,5% при ХТ и 31,4% при гипертрофии небных миндалин. Но разбивка по возрастным категориям уточнила, что H. pylori выделяется преимущественно у взрослых пациентов (56,5% при ХТ и 31,4% при гипертрофии небных миндалин), а вот у детей лишь при наличии ХТ (40,7 и 0% соответственно). Проведенное H. pylori-позитивным пациентам эндоскопическое обследование выявило признаки ЛФР. Данная работа некоторым образом подтвердила связь H. pylori-инфекции, ЛФР и ХТ.
Работы подобного дизайна оценивали частоту выделения H. pylori у пациентов с ХНФ, группой контроля служили здоровые добровольцы. H. pylori-позитивные пациенты статистически достоверно чаще (р=0,002) имели ХНФ [21]. А вот работы, посвященные роли H. pylori в генезе различных форм среднего отита довольно противоречивы [22–27]: одни признают роль данного микроорганизма в генезе отита [22–25], другие нет [26, 27]. Но все авторы единодушны во мнении, что эта проблема нуждается в продолжении углубленного изучения. Также подчеркивается, что важно обращать внимание на возраст пациентов, так как выявлено, что уровень пепсина в аспиратах из барабанной полости у пациентов первого года жизни повышен чаще, чем у более старших детей, и это коррелировало с частотой гнойных и экссудативных средних отитов у грудничков [28]. Несколькими годами раньше этот же коллектив авторов выявлял повышенный уровень пепсина у пациентов первых 3 лет жизни [29]. В рамках этого же исследования оценивались уровень интерлейкинов (ИЛ-6, ИЛ-8, фактора некроза опухоли) и результаты микробиологического исследования, отделяемого из барабанной полости. Уровень пепсина А коррелировал с уровнем ИЛ-8 и необходимостью проведения повторных шунтирований барабанной полости, а также с повышенной бактериальной обсемененностью. Неизменным оставался вывод: наличие связи между экстраэзофагеальным рефлюксом и воспалением среднего уха и негативным влиянием экстраэзофагеального рефлюкса на течение воспалительного процесса [28, 29]. Тема взаимосвязи ГЭРБ и различных форм отита затрагивалась авторами, оценившими частоту выявления ГЭР у пациентов с острым, РСО и хроническим средним гнойным отитом [30]. Интересны факты: частота выявления ГЭР повышается по мере рецидивирования/хронизации процесса: 58% при остром среднем отите, 61,1% — РСО, 72,7% при хроническом среднем гнойном отите против 22% в группе контроля. Наряду с этим есть публикации, не выявляющие очевидной связи между частотой РСО и хронического экссудативного среднего отита ЭСО, а также изменением микробного пейзажа носоглотки с ГЭР [31]. Найдены и работы, посвященные взаимосвязи состояния глоточной миндалины и рефлюкса [32–34], в обеих говорится о значимости ЛФР/ГЭР в поддержании ее гипертрофии/воспаления, а другие авторы [35] выявили значимость рефлюкса и в рецидиве роста глоточной миндалины. Много публикаций и о связи патологии околоносовых пазух и ГЭР: хотя состоявшийся в 2014 г. конгресс по детскому хроническому риносинуситу не нашел достаточно данных о взаимосвязи этих двух состояний [36], необходимость антирефлюксной терапии (АРТ) активно обсуждается [37–41]. Сторонники применения АРТ приводят данные, что ГЭРБ негативно влияет на нормальное функционирование системы мукоцилиарного транспорта (74% взрослых пациентов с аномальным мукоцилиарным транспортом МЦТ имели экстраэзофагеальные проявления ГЭРБ). Важность АРТ подчеркивается и для пациентов с хроническим полипозным риносинуситом, частота выявления пепсина А у них свыше 60% по сравнению с 11% у контрольной группы.
Говоря об АРТ, большинство работ оценивает эффективность применения ингибиторов протонной помпы (ИПП) [37–41]. На фармацевтическом рынке существует и другой терапевтический класс — эзофагопротекторы (средства для защиты слизистой оболочки пищевода от внешних воздействий). Согласно клиническим рекомендациям РГА по лечению ГЭРБ, эзофагопротекторы — новая фармакологическая группа, единственным представителем которой является медицинское изделие Альфазокс. Он состоит из смеси низкомолекулярной [гиалуроновой кислоты и низкомолекулярного хондроитина сульфата, растворенных в биоадгезивном носителе (полоксамер 407)]. Альфазокс обладает способностью фиксироваться на слизистой оболочке, благодаря чему реализует эффект механической защиты слизистой оболочки от повреждающего действия компонентов рефлюктата (соляной кислоты, пепсина и желчи). Гиалуроновая кислота, входящая в состав препарата, — естественный полимер, участвующий в различных физиологических процессах, включая репарацию, регенерацию и морфогенез [42]. В исследованиях отмечено также дозозависимое противовоспалительное действие данного соединения [42, 43]. Помимо этого в экспериментальных исследованиях in vivo показана способность гиалуроновой кислоты индуцировать экспрессию белков плотных контактов ZO-1, что способствует восстановлению барьерной функции эпителия [43]. Второй компонент Альфазокса — хондроитина сульфат — естественный гликозаминогликан, обладающий иммуномодулирующими, противовоспалительными и антиоксидантными свойствами [44, 45]. Являясь собственным компонентом защитного слоя слизи, хондроитина сульфат связывается с пепсином, ингибируя его [44–47]. Третий компонент Альфазокса, полоксамер 407, представляет собой гидрофильное неионное поверхностно активное вещество [48]. Адгезивные свойства полоксамера 407 обеспечивают фиксацию комплекса гиалуроновой кислоты и хондроитина сульфата на слизистой оболочке пищевода в течение длительного времени [49, 50].
Почему именно данный препарат может быть интересен в аспекте применения у пациентов с экстраэзофагеальными ЛОР-проявлениями ГЭРБ? Как описано ранее, Альфазокс фиксируется на слизистой оболочке пищевода, но до попадания в пищевод он контактирует со слизистой оболочкой рото- и гортаноглотки (по аналогии взаимодействия пищевого комка или контрастного вещества, используемого при эндоскопической диагностике нарушений орофарингеальный фазы глотания) и фиксируется на ней благодаря мукоадгезивным свойствам [51].
Альфазокс оказывает свое действие на поверхности слизистой оболочки верхних отделов пищеварительного тракта, не проникая в системный кровоток, а также обладает низким аллергенным потенциалом. В клинических исследованиях безопасность Альфазокса не отличалась от плацебо, аллергических реакций не выявлено [52–54].
Альфазокс оказывает заживляющее и восстанавлива-ющее действие при эрозивных повреждениях эпителия пищевода [42]. Согласно результатам нескольких многоцентровых клинических исследований, комбинация Альфазокса и ИПП позволяла более эффективно добиться регрессии клинических проявлений заболевания и улучшения качества жизни пациентов (согласно опроснику SF36) по сравнению с монотерапией ИПП [55–57]. В клинических исследованиях доказана эффективность при применении Альфазокса в течение 4–5 нед [55–57]. Таким образом, применение Альфазокса для устранения экстраэзофагеальных проявлений ГЭРБ представляет значительный интерес и требует дальнейших исследований.
1. Mosca F, Rossillo V, Leone CA. Manifestations of gastro-pharyngolaryngeal reflux disease. Acta Otorhinolaryngol Ital. 2006;26(5):247-51
2. Федеральные клинические рекомендации по диагностике и лечению гастроэзофагеальной рефлюксной болезни у детей. Союз педиатров России. 2015 г. [Federal clinical guidelines for the diagnosis and treatment of gastroesophageal reflux disease in children. Union of Pediatricians of Russia. 2015 (In Russ)]
3. Рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению гастроэзофагеальной рефлюксной болезни. 2020 г. [Recommendations of the Russian Gastroenterological Association for the diagnosis and treatment of gastroesophageal reflux disease. 2020 (In Russ)]
4. R.T. Sataloff, D.O. Castell, P.O. Katz, D.M. Sataloff. Reflux-laryngitis and related disorders. 3rd edition. Plural Publishing, Inc, San Diego, Oxford, 2006- 161p.
5. Massawe WA, Nkya A, Abraham ZS, et al. Laryngopharyngeal reflux disease, prevalence and clinical characteristics in ENT department of a tertiary hospital Tanzania. World J Otorhinolaryngol Head Neck Surg. 2020;7(1):28-33. doi: 10.1016/j.wjorl.2020.04.009. PMID: 33474541; PMCID: PMC7801257
6. Han H, Lyu Q, Zhao J. Laryngopharyngeal Reflux in Hypertrophic Laryngeal Diseases. Ear Nose Throat J. 2020; p. 145561320953232. doi: 10.1177/0145561320953232
7. Reiter R, Heyduck A, Seufferlein T, et al. Laryngopharyngealer Reflux [Laryngopharyngeal Reflux]. Laryngorhinootologie. 2018;97(4):238-45. doi: 10.1055/s-0044-100794
8. Włodarczyk E, Jetka T, Raj-Koziak D, et al. Diagnosis of laryngopharyngeal reflux in children with voice disorders using 24-hour pharyngeal pH monitoring. Int J Pediatr Otorhinolaryngol. 2019;121:188-96. doi: 10.1016/j.ijporl.2019.03.010
9. Saniasiaya J, Kulasegarah J. Dysphonia and reflux in children: A systematic review. Int J Pediatr Otorhinolaryngol. 2020;139:110473. doi: 10.1016/j.ijporl.2020.110473
10. Saniasiaya J, Kulasegarah J. Dysphonia and reflux in children: A systematic review. Int J Pediatr Otorhinolaryngol. 2020;139:110473. doi: 10.1016/j.ijporl.2020.110473
11. Wertz A, Carroll LM, Zur KB. Pediatric laryngopharyngeal reflux: Perceptual, acoustic, and laryngeal findings. Int J Pediatr Otorhinolaryngol. 2020;133:109974. doi: 10.1016/j.ijporl.2020.109974
12. De Bortoli N, Nacci A, Savarino E, et al. How many cases of laryngopharyngeal reflux suspected by laryngoscopy are gastroesophageal reflux disease-related? World J Gastroenterol. 2012;18(32):4363-70. doi: 10.3748/wjg.v18.i32.4363
13. Abou-Ismail A, Vaezi MF. Evaluation of patients with suspected laryngopharyngeal reflux: a practical approach. Curr Gastroenterol Rep. 2011;13(3):213-8. doi: 10.1007/s11894-011-0184-x
14. Drug VL, Cobzeanu D, Papaghiuc C, et al. Implicarea bolii de reflux gastroesofagian in patologia orl [Gastroesophageal reflux involvement in ENT disorders]. Rev Med Chir Soc Med Nat Iasi. 2005;109(2):220-2. PMID: 16607774
15. Wang JS, Li JR. The role of laryngopharyngeal reflux in the pathogenesis of Reinke’s edema. Lin Chung Er Bi Yan Hou Tou Jing Wai Ke Za Zhi. 2016;30(24):1931-4. doi: 10.13201/j.issn.1001-1781.2016.24.007
16. Wolford RW, Goyal A, Belgam Syed SY, Schaefer TJ. Pharyngitis. 2020 Nov 20. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2021. PMID: 3013783
17. Zeng S, Chen J, Wei X, et al. Clinical observation of the anti-reflux treatment for the chronic pharyngitis patients with the reflux finding score from 8 to 10. Lin Chung Er Bi Yan Hou Tou Jing Wai Ke Za Zhi. 2020;34(5):441-3. doi: 10.13201/j.issn.2096-7993.2020.05.013
18. Yazici ZM, Sayin I, Kayhan FT, Biskin S. Laryngopharyngeal reflux might play a role on chronic nonspecific pharyngitis. Eur Arch Otorhinolaryngol. 2010;267(4):571-4. doi: 10.1007/s00405-009-1044-2
19. Hwang MS, Forman SN, Kanter JA, Friedman M. Tonsillar Helicobacter pylori colonization in chronic tonsillitis: systematic review and meta-analysis. JAMA Otolaryngol Head Neck Surg. 2015;141(3):245-9. doi: 10.1001/jamaoto.2014.3296
20. Siupsinskiene N, Katutiene I, Jonikiene V, et al. Helicobacter pylori in the tonsillar tissue: a possible association with chronic tonsillitis and laryngopharyngeal reflux. J Laryngol Otol. 2017;131(6):549-56. doi: 10.1017/S0022215117000597
21. Kaptan ZK, Emir H, Uzunkulaoğlu H, et al. Determination of Helicobacter pylori in patients with chronic nonspecific pharyngitis. Laryngoscope. 2009;119(8):1479-83. doi: 10.1002/lary.20253
22. Fancy T, Mathers PH, Ramadan HH. Otitis media with effusion: a possible role for Helicobacter pylori? Otolaryngol Head Neck Surg. 2009;140(2):256-8. doi: 10.1016/j.otohns.2008.11.023
23. Karlidag T, Bulut Y, Keles E, et al. Detection of Helicobacter pylori in children with otitis media with effusion: a preliminary report. Laryngoscope. 2005;115(7):1262-5. doi: 10.1097/01.MLG.0000165697.83921.2B
24. Du P, Zong S, Wen Y, et al. Association between Helicobacter pylori and otitis media with effusion in children: A systematic review. Int J Pediatr Otorhinolaryngol. 2020;135:110091. doi: 10.1016/j.ijporl.2020.110091
25. Wu X, Zheng Y, Gao X, et al. Association Between Helicobacter pylori Infection and Otitis Media With Effusion Risk in Children: A Systematic Review and Meta-analysis. Otolaryngol Head Neck Surg. 2020;163(4):654-61. doi: 10.1177/0194599820921861
26. Boronat-Echeverría N, Aguirre-Mariscal H, Carmolinga-Ponce M, et al. Helicobacter pylori detection and clinical symptomatology of gastroesophageal reflux disease in pediatric patients with otitis media with effusion. Int J Pediatr Otorhinolaryngol. 2016;87:126-9. doi: 10.1016/j.ijporl.2016.06.023
27. Khasawneh L, Khassawneh AH, Kheirallah KA, et al. Otitis media with effusion: The role of Helicobacter Pylori in its pathogenesis. Ann Med Surg (Lond). 2021;62:278-82. doi: 10.1016/j.amsu.2021.01.056
28. O’Reilly RC, He Z, Bloedon E, et al. The role of extraesophageal reflux in otitis media in infants and children. Laryngoscope. 2008;118 (Suppl. 116):1-9. doi: 10.1097/MLG.0b013e31817924a3
29. O’Reilly RC, Soundar S, Tonb D, et al. The role of gastric pepsin in the inflammatory cascade of pediatric otitis media. JAMA Otolaryngol Head Neck Surg. 2015;141(4):350-7. doi: 10.1001/jamaoto.2014.3581
30. Abtahi SH, Kazerooni A, Brejis N, et al. Prevalence and characteristics of gastroesophageal reflux in children with otitis media in Isfahan, Iran. Adv Biomed Res. 2016;5:81. doi: 10.4103/2277-9175.182212
31. Boers SA, de Zeeuw M, Jansen R, et al. Characterization of the nasopharyngeal and middle ear microbiota in gastroesophageal refluxprone versus gastroesophageal reflux non-prone children. Eur J Clin Microbiol Infect Dis. 2018;37(5):851-7. doi: 10.1007/s10096-017-3178-2
32. Huang YD, Tan JJ, Han XY, et al. Study on the correlation between adenoid hypertrophy and laryngopharyngeal reflux in children. Lin Chung Er Bi Yan Hou Tou Jing Wai Ke Za Zhi. 2018;32(12):899-904. doi: 10.13201/j.issn.1001-1781.2018.12.005
33. Niu X, Wu ZH, Xiao XY, Chen X. The relationship between adenoid hypertrophy and gastroesophageal reflux disease: A meta-analysis. Medicine (Baltimore). 2018;97(41):e12540. doi: 10.1097/MD.0000000000012540
34. Keles B, Ozturk K, Arbag H, et al. Frequency of pharyngeal reflux in children with adenoid hyperplasia. Int J Pediatr Otorhinolaryngol. 2005;69(8):1103-7. doi: 10.1016/j.ijporl.2005.02.019
35. Johnston J, Mahadevan M, Douglas RG. Incidence and factors associated with revision adenoidectomy: A retrospective study. Int J Pediatr Otorhinolaryngol. 2017;103:125-8. doi: 10.1016/j.ijporl.2017.10.023
36. Brietzke SE, Shin JJ, Choi S, et al. Clinical consensus statement: pediatric chronic rhinosinusitis. Otolaryngol Head Neck Surg. 2014;151(4):542-53. doi: 10.1177/0194599814549302
37. Rosen R, Vandenplas Y, Singendonk M, et al. Pediatric gastroesophageal reflux clinical practice guidelines. J Pediatr Gastroenterol Nutr. 2018;66(3):516-54. doi: 10.1097/MPG.0000000000001889
38. Goldsmith AJ, Rosenfeld RM. Treatment of pediatric sinusitis. Pediatr Clin N Am. 2003;50(2):413-26. doi: 10.1016/s0031-3955(03)00027-0
39. El-Serag HB, Gilger M, Kuebeler M, Rabeneck L. Extraesophageal associations of gastroesophageal reflux disease in children without neurologic defects. Gastroenterology. 2001;121(6):1294-9. doi: 10.1053/gast.2001.29545
40. Dewan K, Lieu J. A Clinical Trial of Proton Pump Inhibitors to Treat Children with Chronic Otitis Media with Effusion. J Int Adv Otol. 2018;14(2):245-9. doi: 10.5152/iao.2018.4286
41. Bothwell MR, Parsons DS, Talbot A, et al. Outcome of reflux therapy on pediatric chronic sinusitis. Otolaryngol Head Neck Surg. 1999;121(3):255-62. doi: 10.1016/S0194-5998(99)70181-6
42. Savarino E, Zentilin P, Marabotto E, et al. Drugs for improving esophageal mucosa defense: where are we now and where are we going? Ann Gastroenterol. 2017;30(6):585-91. doi: 10.20524/aog.2017.0187
43. Gaffney J, Matou-Nasri S, Grau-Olivares M, Slevin M. Therapeutic applications of hyaluronan. Mol Biosyst. 2010; 6(3):437-43. doi: 10.1039/b910552m
44. Ialenti A, Di Rosa M. Hyaluronic acid modulates acute and chronic inflammation. Agents Actions. 1994; 43(1-2):44-7. doi: 10.1007/BF02005763
45. Nolan A, Baillie C, Badminton J, et al. The efficacy of topical hyaluronic acid in the management of recurrent aphthous ulceration. J Oral Pathol Med. 2006;35:461-5. doi: 10.1111/j.1600-0714.2006.00433.x
46. Kim Y, Kessler SP, Obery DR, et al. Hyaluronan 35kDa treatment protects mice from Citrobacter rodentium infection and induces epithelial tight junction protein ZO-1 in vivo. Matrix Biol. 2017;62:28-39. doi: 10.1016/j.matbio.2016.11.001
47. Volpi N. Anti-inflammatory activity of chondroitin sulphate: new functions from an old natural macromolecule. Inflammopharmacology. 2011;19(6):299-306. doi: 10.1007/s10787-011-0098-0
48. Du Souich P, Garcia AG, Verges J, Montell E. Immunomodulatory and anti-inflammatory effects of chondroitin sulphate. J Cell Mol Med. 2009;13:1451-63. doi: 10.1111/j.1582-4934.2009.00826.x
49. Bonfils S, Dubrasquet M, Lambling A. The inhibition of peptic proteolysis by various polysaccharides. Rev Fr Etud Clin Biol. 1960;5:71-4
50. Galzigna L, Previerocoletti MA. Action of sodium chondroitin sulfate on the enzymatic activity of pepsin. Gazz Med Ital. 1965;124:65-7
51. Практические рекомендации всемирной гастроэнтерологической организации Дисфагия. Глобальные практические рекомендации и Каскады. Режим доступа: https://www.worldgastroenterology.org/UserFiles/file/guidelines/dysphagia-russian-2014.pdf. Ссылка активна на 29.03.2021 [Practical recommendations of the world gastroenterological organization Dysphagia. Global Best Practices and Cascades. Access mode: https://www.worldgastroenterology.org/UserFiles/file/guidelines/dysphagia-russian-2014.pdf. Link is active on 03|29|2021 (In Russ)]
52. Lenzi G, Rapino P, Ferri S. On the behavior of gastric hydrochloric and peptic activity after administration of sodium chondroitin sulfate. Minerva Med. 1963;54:3421-4
53. Ramya Devi D, Sandhya P, Vedha Hari BN. Poloxamer: a novel functional molecule for drug delivery and gene therapy. J Pharm Sci Res. 2013;5:159-65
54. Dumortier G, Grossiord JL, Agnely F, Chaumeil JC. A review of poloxamer 407 pharmaceutical and pharmacological characteristics. Pharm Res. 2006; 23(12):2709-28. doi: 10.1007/s11095-006-9104-4
55. Palmieri B, Corbascio D, Capone S, Lodi D. Preliminary clinical experience with a new natural compound in the treatment of esophagitis and gastritis: symptomatic effect. Trends Med. 2009;9:219-25
56. Palmieri B, Merighi A, Corbascio D, et al. Fixed combination of hyaluronic acid and chondroitin-sulphate oral formulation in a randomized double blind, placebo controlled study for the treatment of symptoms in patients with non-erosive gastroesophageal reflux. Eur Rev Med Pharmacol Sci. 2013;17:3272-8
57. Savarino V, Pace F, Scarpignato C, Esoxx Study Group Randomised clinical trial: mucosal protection combined with acid suppression in the treatment of non-erosive reflux disease — efficacy of Esoxx, a hyaluronic acid-chondroitin sulphate based bioadhesive formulation. Aliment Pharmacol Ther. 2017;45:631-42. doi: 10.1111/apt.13914







