Представления об эозинофильном эзофагите динамично меняются: появляются новые данные об эпидемиологии, патогенезе, диагностике и лечении, полученные в ходе крупных обсервационных и клинических исследований. С другой стороны, в литературе практически отсутствуют данные об IgG4-связанном поражении пищевода. В статье приведен клинический случай: история развития язвы и стриктуры пищевода у молодого человека 17 лет. Описаны трудности диагностики и лечения, представлены современные данные о взаимосвязи эозинофильного эзофагита и патологического IgG4-ответа.
В последние годы в зарубежной и отечественной медицинской литературе все больше уделяется внимания эозинофильному эзофагиту (ЭоЭ). Это — хроническое иммуно/антиген-опосредованное заболевание, характеризующееся выраженной эозинофильной инфильтрацией слизистой оболочки пищевода, клинически проявляющееся дисфункцией (дисфагией) и гистологически — эозинофильной инфильтрацией эпителия (с количеством эозинофилов ≥15 в поле зрения при при увеличении ×400), при отсутствии других причин локальной или системной эозинофилии [1, 2]. Изучение ЭоЭ является динамически развивающимся направлением в гастроэнтерологии: появляются новые данные об эпидемиологии, патогенезе, диагностике и лечении, полученные в ходе крупных обсервационных и клинических исследований, которые легли в основу экспертных документов и клинических рекомендаций американских, европейских и отечественных научных обществ [2-5]. Эозинофильный эзофагит, занимая второе место в структуре патологии пищевода после ГЭРБ, представляет собой большую медико-социальную проблему в связи с хроническим течением, значимым снижением качества жизни пациентов, а также возможностью развития осложнений — стриктур и сужений пищевода, необходимостью эндоскопических и даже хирургических вмешательств [2, 6]. Несмотря на то, что распространенность ЭоЭ по данным Американской Гастроэнтерологической Ассоциации составляет 22,7 на 100000 взрослого населения (95% ДИ, 12,4–36,0) и у детей — 29,5 на 100000 (95% ДИ 17,5–44,7), в литературе имеется недостаточное количество исследований, посвященных патогенезу, течению и лечению болезни [7, 8]. Плохая осведомленность врачей первичного звена, гастроэнтерологов о данной проблематике приводит к тому, что эозинофильный эзофагит в отечественной популяции выявляется крайне редко, а пациенты часто проходят долгий путь до постановки окончательного диагноза [9].
Мы полагаем, что представленный ниже клинический случай ЭоЭ поможет осветить некоторые проблемы патогенеза, клинической картины и дифференциальной диагностики, подходов к тактике лечения.
На кафедру внутренних болезней, клинической фармакологии и нефрологии СЗГМУ им. И.И. Мечникова обратился молодой человек 17 лет в сопровождении родителей.
На момент обращения, пациента беспокоили затруднения при проглатывании твердой пищи на уровне средней трети грудины; загрудинный дискомфорт при проглатывании жидкости, возникающий несколько раз в месяц; боли между лопатками во время еды; ощущение сжатия за грудиной после употребления орехов, фруктов; регургитация желудочного содержимого, возникающая ночью примерно 1 раз в месяц после объемного ужина.
Из анамнеза жизни известно, что пациент родился от первой беременности. На сроке 6 недель существовала угроза прерывания беременности, срочные роды (40 недель) прошли без осложнений. Пациент находился на грудном вскармливании до 1 года 8 месяцев, прикормы вводились по возрасту. На момент обращения обучается в 11 классе общеобразовательной школы, регулярно 2-3 раза в неделю занимается фитнесом. Пациент страдает сезонной аллергией по типу конъюнктивита и ринита, длящейся с апреля по август, на фоне цветения растений. Наследственность отягощена: мать пациента страдает сезонной аллергией, отца беспокоит постоянная изжога (эндоскопически не обследовался), у бабушки и дедушки по отцовской линии диагностирована язвенная болезнь 12-перстной кишки.
Со слов матери, в 3 месяца у пациента отмечался неустойчивый стул, из кала выделялся S. aureus, проводилась терапия бактериофагами. С 1 года у ребенка появляются мокнущие пятна на руках и шее, с 2-летнего возраста устанавливается диагноз атопического дерматита. В 3 года пациент переносит острый энтероколит (патоген не установлен), после чего до 10-летнего возраста отмечается неоформленный стул. В трехлетнем возрасте у пациента выявляются лямблии и аскариды в стуле, в клиническом анализе крови впервые умеренная эозинофилия. Прошел курс терапии. В этом же возрасте у пациента появляются раскачивания туловища из стороны в сторону практически во время каждого приема пищи, что трактуется неврологом, как синдром навязчивых движений на резидуальном фоне. Проводимая терапия нейропротекторами неэффективна.
В 8 лет ребенку впервые проводится комплексное обследование в клинике СПбГПМУ. В процессе обследования выявляется увеличение уровня общего IgЕ до 559 МЕ/мл (N=0-124 МЕ/мл), наличие IgЕ к молочному и яичному белку, пшенице, овсу, эпителию кошки, пыльце деревьев; повышение антиглиадиновых IgA до 188,2 Ед/мл (N до 35 Ед/мл), при этом уровни антиглиадиновых IgG, антител к тканевой трансглутаминазе классов IgA и G не выходят за референсные значения. Фекальный кальпротектин повышен до 255 мкг/г (N до 100 мкг/г), однако ANCA (aнтинейтрофильные цитоплазматические антитела), ASCA (антитела к Sacchаromyces cerevisiae), антитела к бокаловидным клеткам кишечника и антитела к экзокринной части поджелудочной железы в пределах нормы. При проведении эзофагогастродуоденоскопии (ЭГДС) определяется эрозивно-язвенный эзофагит. В биоптате слизистой залуковичного отдела 12-перстной кишки отмечается неравномерная умеренная атрофия ворсинок, количество межэпителиальных лимфоцитов (МЭЛ) повышено до 23 на 100. В строме умеренно выраженная инфильтрация плазматическими клетками, лимфоцитами, примесь нейтрофилов и эозинофилов. При проведении видеоколоноскопии (ВКС) выявляется нодулярный терминальный илеит. Гистологическая картина соответствует поверхностному воспалению, наиболее выраженному в подвздошной кишке, в толстой кишке имеются признаки слабой воспалительной лимфоплазмоцитарной инфильтрации с незначительной примесью нейтрофилов и эозинофилов.
На основании полученных данных в 8 лет был установлен основной диагноз целиакии, ГЭРБ, эрозивно-язвенного эзофагита, постинфекционного колита, затяжного течения. Сопутствующими заболеваниями являлись атопический дерматит, пищевая сенсибилизация к белку коровьего молока, яичному белку, пшенице и овсу. Было рекомендовано: безглютеновая диета, курсовая терапия ИПП, сезонная противоаллергическая терапия.
С 8 до 11 лет пациента продолжала беспокоить дисфагия, неустойчивый стул, появляются рецидивирующие артралгии, в связи с чем находился под наблюдением педиатра, гастроэнтеролога, несколько раз госпитализировался в гастроэнтерологическое отделение для проведения комплексного дообследования и лечения. При лабораторном обследовании выявлялось повышение уровня кальпротектина (максимальное значение — 898 мкг/г), Ig E (максимальное значение — 450 МЕ/л). При проведении эндоскопического обследования ежегодно диагностировались эрозии в пищеводе, терминальный нодулярный илеит, эпизодически эрозивно-язвенный эзофагит. На фоне двухмесячной терапии ИПП отмечалась эпителизация участков повреждения в пищеводе.
С 8 до 11 лет выставлялись диагнозы ГЭРБ, эрозивный эзофагит, аллергическая энтеропатия на фоне сенсибилизации к глютену, белку коровьего молока, подозревалась болезнь Крона. Терапия препаратами 5-аминосалициловой кислоты в дозировке 1500 мг в сутки в течение 3 месяцев не эффективна. На фоне длительной безглютеновой диеты самочувствие и лаботаторные показатели значимо не изменялись.
С 10 до 17 лет самочувствие пациента относительно хорошее, к врачам не обращался. Специфической диеты, в том числе безглютеновой, не соблюдал. Ежегодные сезонные весенне-летние эпизоды аллергии у пациента сопровождались в анализе крови гиперэозинофилией и повышением уровня IgE. В остальное время года уровень эозинофилов и IgE не выходили за референсные значения. На фоне длительного (не менее часа) и тщательного (до гомогенной жидкой массы) пережевывания пищи дисфагия возникала редко. Учитывая дисфагию при употреблении фруктов, орехов и молока, больной полностью отказался от этих продуктов. Для профилактики эпизодов ночной регургитации сформировалась привычка спать с приподнятым головным концом кровати. При появлении и нарастании пищеводной симптоматики больной с хорошим клиническим эффектом принимал 7-10 дней ИПП — 3-4 курса в течение года.
Осенью 2019 года пациент обращается на кафедру внутренних болезней, клинической фармакологии и нефрологии СЗГМУ им. И.И. Мечникова по поводу нарастания дисфагии и одинофагии, появлением рвоты, съеденной пищей, похудением на 7 кг за месяц. При проведении ЭГДС пищевод свободно проходим до нижней трети, на глубине 35 см на границе средней и нижней трети обнаружена язва, занимающая 2/3 окружности пищевода, стриктура (диаметр пищевода до 11 мм), проходимая для эндоскопа. Выраженных изменений при осмотре слизистой желудка и 12-перстной кишки не выявлено. Таким образом, у пациента была диагностирована язва нижней трети пищевода, компенсированный рубцовый стеноз нижней трети пищевода. При гистологическом исследовании биоптатов из нижней трети пищевода была выявлена интраэпителиальная неоплазия низкой степени на фоне выраженной эозинофильной инфильтрации, что послужило поводом для беспокойства и углубленного обследования пациента.
При проведении рентгеноскопии пищевода и желудка с барием грыжа пищеводного отверстия диафрагмы не определялась.
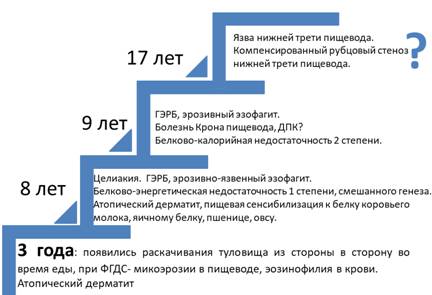
На рисунке 1 схематично представлен анамнез заболевания с появления первых симптомов до развития язвы пищевода и субкомпенсированного стеноза пищевода.
Рис. 1. Анамнез заболевания (схематично).
Проведеное обследование выявило в анализах крови повышение эозинофилов до 15%, суммарного IgE до 340 МЕ/мл (норма до 100,0 Ме/мл). Проведен анализ на глистные инвазии: IgG к антигенам описторхий, эхинококков, трихинелл, токсокар (-), Ig A,M,G к лямблиям (-), исследование кала на яйца гельминтов и цисты простейших (-). Данных за глистную инвазию не получено. Генетический скрининг на целиакию — не выявлены гаплотипы HLA-DQ2 и HLA-DQ8.
Биопсийный материал пациента с 2012 года был пересмотрен в морфологическом центре экспертного уровня с привлечением нескольких морфологов.
Фотографии биопсийного материала слизистой пищевода от 2012 представлены на рисунке 2.
Рис. 2. Слизистая оболочка пищевода 2012 год. (окраска гематоксилином-эозином, х40, х200)
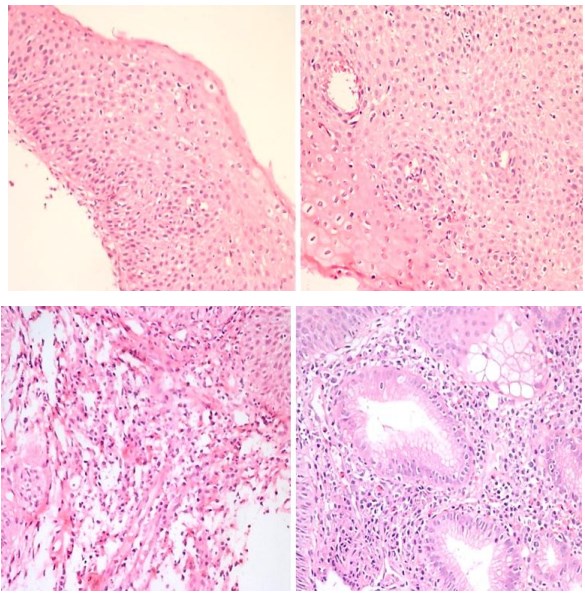
В биопсийном материале от 2012 года были выявлены фрагменты слизистой оболочки области пищеводно-желудочного соустья с умеренным воспалительным компонентом, участками желёз кардиального типа, без признаков кишечной метаплазии и интраэпителиальной неоплазии. Учитывая выявление 25-30 межэпителиальных эозинофильных лейкоцитов в поле зрения при увеличении х400, гистологическая картина расценена как эозинофильный эзофагит.
Биопсийный материал от 2019 года был проанализирован, в том числе с применением иммуногистохимических методов, направленных на оценку характера клеточной инфильтрации, выявление межэпителиальных эозинофильных лейкоцитов и иммуноглобулинов G4. Фотографии биопсийного материала слизистой пищевода от 2019 представлены на рисунке 3, фотографии иммуногистохимических исследований на рисунке 4.
Рис. 3. Слизистая оболочка пищевода 2019 год. (окраска гематоксилином-эозином, х40, х200).
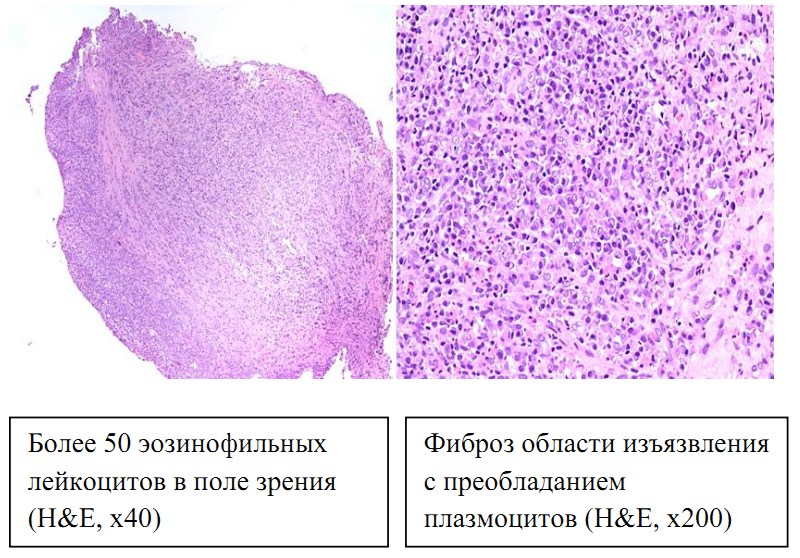
При анализе биопсийного материала определялись выраженное утолщение краевого многослойного плоского эпителия, значительный воспалительный компонент без признаков кишечной метаплазии и интраэпителиальной неоплазии. По сравнению с 2012 годом — увеличилось количество межэпителиальных лейкоцитов (более 50 эозинофильных лейкоцитов в поле зрения при х400), присутствует примесь эозинофильных лейкоцитов, в том числе в виде скоплений по типу эозинофильных микроабсцессов. Обращало на себя внимание то, что биоптат из зоны изъявления пищевода был представлен грубоволокнистой фиброзной тканью с большим количеством эозинофилов и плотной диффузно-очаговой инфильтрацией плазматическими клетками, которая местами напоминала опухолеподобный характер. При проведении иммуногистохимического исследования установлено, что практический весь клеточный массив плазматических клеток (CD138+), которые интенсивно экспрессировал IgG4. Результаты представлены на рисунке 4.
Рис.4. Слизистая оболочка из дна язвы пищевода, 2019 год (иммуногистохимическое исследование).
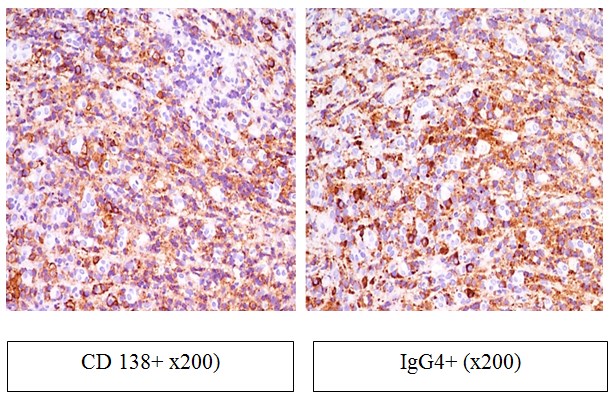
У пациента диагностирован хронический эрозивно-язвенный эзофагит с умеренным воспалительным компонентом, формированием грануляционной ткани, регенераторными изменениями краевого многослойного плоского эпителия. Наличие 35-40 межэпителиальных эозинофильных лейкоцитов в поле зрения при 400-кратном увеличении критериально свидетельствует о наличии эозинофильного эзофагита. При проведении иммуногистохимического исследования выявлена плотная IgG4+ плазмоклеточная инфильтрация грануляционной ткани (50-70 IgG4-позитивных плазматических клеток в поле зрения при х400), что соответствует критериальным признакам IgG4- связанного поражения пищевода.
Симптомы дисфагии, эндоскопичеcкая картина, выявленные морфологические изменения потребовали назначение патогенетической стероидной терапии — 40 мг преднизолона (0,6 мг/кг/сутки) в течении месяца с последующим снижением дозы на 10 мг каждые две недели до поддерживающей дозы 5 мг в течении 3-х месяцев и переходом на пероральный прием будесонида по схеме, рекомендованной для лечения ЭоЭ. Также инициирована базисная терапия ИПП — декслансопразолом в дозе 60 мг с переходом через 12 недель на постоянную поддерживающую терапию 30 мг декслансопразола. Кроме того, пациент длительно лечился эзофагогастропротектором — Альфазоксом. На фоне терапии достигнута клиническая ремиссия — купировалась дисфагия, болевой синдром за грудиной, нормализовался вес. По данным контрольной ЭГДС, проведенной через 3 месяца после начала терапии, положительная динамика — эпителизация язвенного дефекта, уменьшение выраженности стеноза пищевода. При анализе динамического биопсийного материала значительно уменьшилось количество межэпителиальных эозинофильных лейкоцитов (менее 25 в поле зрения при х400), эозинофильные микроабсцессы не определялись, в области эпителизировавшегося изъязвления резко снизилась плотность инфильтрации плазматическими клетками. В настоящее время пациент продолжает наблюдаться, получает базовую терапию ИПП.
Представленный клинический случай иллюстрирует возможность у одного пациента, на основании динамического морфологического исследования биоптатов пищевода, критериально верифицировать два патологических состояния: эозинофильный эзофагит и IgG4-ассоциированное поражение пищевода.
Рассмотрим критерии диагностики каждого из приведенных состояний. Эозинофильный эзофагит:
Критерии диагностики ЭоЭ (EoE-specific histologic scoring system (EoEHSS) — интраэпителиальная эозинофильная инфильтрация с обнаружением >15 эозинофильных лейкоцитов в поле зрения при увеличении х400. Дополнительные критерии: эозинофильные микроабсцессы; гиперплазия базального слоя эпителия; расширение межклеточных пространств; расположение эозинофилов в поверхностных слоях эпителия; мастоцитарная и лимфоцитарная инфильтрация; удлинение сосочков и фиброз собственной пластинки слизистой оболочки [10, 11].
IgG4-ассоциированное поражение пищевода:
Гистологические признаки IgG4-связанных заболеваний (IgG4-СЗ) — плотный лимфоплазмоцитарный инфильтрат; фиброз; >10 IgG4+ плазматических клеток в поле зрения (х400); IgG4+/IgG+ соотношение >40% [12].
Что же лежит в этиологии и патогенезе ЭоЭ и IgG4-связанного заболевания, где точки соприкосновения данных патологий? Является ли эозинофильный эзофагит — IgG4-связанным заболеванием, или повышение количества IgG4+ плазматических клеток в биоптате слизистой пищевода — это иммунная (возможно, защитная) реакция на атопическое воспаление?
Многие авторы полагают, что в патогенезе ЭоЭ имеют значение следующие факторы: воздействие воздушных и пищевых аллергенов, генетическая предрасположенность и активация Т-хелперов 2-го типа (Th2) [6, 13-16].
Пищевые и воздушные аллергены внешней среды считаются триггерами ЭоЭ, которые, попадая на слизистую оболочку пищевода, инициируют развитие патологического генетически детерминированного иммуновоспалительного процесса [16, 17]. В настоящее время известно более 90 генетических нарушений, большинство из которых приводит к нарушению белков плотных контактов, в следствии чего самые обычные антигены могут проникать в глубокие отделы слизистой оболочки и контактировать с антигенпрезентирующими клетками [18]. У пациентов с ЭоЭ обнаружена мутация в гене TSLP, кодирующем синтез тимического стромального лимфопоэтина, а также мутации в гене, кодирующем синтез рецептора к тимическому стромальному лимфопоэтину (TSLPR), расположенных в сцепленных с полом хромосомах Xp22.3 и Yp11, с чем связано преобладание лиц мужского пола среди больных ЭоЭ [19-22]. Повышенная экспрессия TSLP активирует иммунокомпетентные клетки, в частности дендритные клетки и мастоциты, способствуя детерминации иммунного ответа по Тh2- зависимому пути [19-22]. В биоптатах слизистой оболочки пищевода пациентов с эозинофильным эзофагитом выявлены повышенные уровни таких интерлейкинов (ИЛ) как ИЛ-4, ИЛ-5, ИЛ-10 и ИЛ-13, которые являются основными цитокинами активации Th2-пути [23-26]. В то же время, ИЛ-4 и ИЛ-13 приводят к вовлечению в процесс фибробластов и эндотелиоцитов, происходит гиперплазия базального слоя эпителия и гладкомышечных клеток, активация фиброгенеза и ангионеогенеза в подслизистом слое, что в конечном итоге приводит к потере эластичности ткани и образованию стриктур пищевода [21, 23, 24]. Следует отметить, что ряд исследователей при иммунногистохимическом исследовании биоптатов у пациентов с ЭоЭ также выявляли значительное повышение количество IgG4± клеток, на чем мы остановимся ниже [27-29].
Как ЭоЭ, IgG4-связанные заболевания также в своем патогенезе имеют детерминацию иммунного ответа по Тh2-зависимому пути, активация которого сопровождается появлением цитокиновых каскадов с вовлечением в процесс целого ряда клеточных элементов и повышением содержания IL-4, IL-5 и IL-10 [30-32]. Данные интерлейкины прямым и опосредованным образом влияют на количество плазматических клеток, экспрессирующих IgG4, что приводит к развитию характерной патоморфологической картины — облитерирующего флебита и фибросклероза [30, 31]. Описана роль ИЛ-5 в качестве отдельного патофизиологического агента в этом комплексе иммунного ответа с вовлечением в процесс эозинофильных лейкоцитов, повышенное содержание которых всегда можно наблюдать у пациентов с IgG4-связанными заболеваниями (IgG4-СЗ) [30, 34]. Патофизиологические аспекты IgG4-СЗ представлены на рисунке 5 [30-34, 36]. Независимо от локализации очаги поражения при IgG4-ассоциированной болезни имеют сходную патоморфологическую картину: муароподобный фиброз, облитерирующий флебит и лимфоплазмоцитарный инфильтрат с высоким содержанием IgG4±клеток и соотношением IgG4+/ IgG±клеток >40% [12, 35]. При этом до 40% пациентов с IgG4-ассоциированной болезнью могут иметь нормальный уровень IgG4 в сыворотке крови [31, 35].
Рис. 5 — Патофизиологические аспекты IgG4-связанных заболеваний [36].
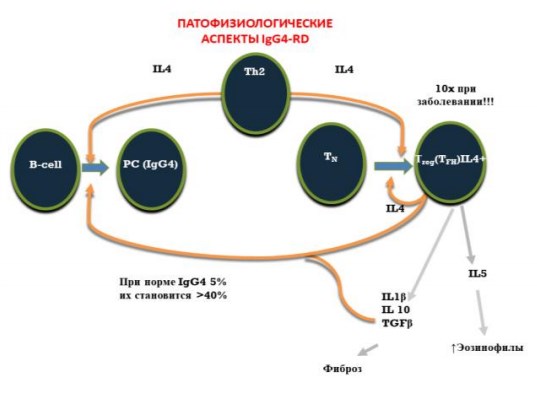
Роль IgG4 в иммунном ответе.
Номенклатура заболеваний и синдромов, связанных с патологическим накоплением IgG4, продолжает развиваться и уточняться. Так, в медицинской литературе IgG4-СЗ также обозначается как: IgG4-связанное системное заболевание, IgG4-связанное склерозирующее заболевание, мультифокальный фибросклероз, IgG4-мультиорганное лимфопролиферативное нарушение, системный IgG4-связанный плазматический синдром и др. Отсутствие единой номенклатуры, терминологии по IgG4-зависимым состояниям, четких единых критериев верификации заболевания усложняет как поиск информации, так и взаимопонимание специалистов, участвующих в разработке данной проблемы [36].
IgG4 — подкласс IgG с минимальной из всех известных четырех подклассов данного иммуноглобулина концентрацией в сыворотке крови (в среднем — 0,35—0,51мг/мл). У здоровых людей содержание IgG4 в сыворотке крови подвержено значительным колебаниям, чаще всего в пределах 10–1,4 мг/мл; уровень ≥2 мг/мл отмечают в редких случаях; содержание этого иммуноглобулина в целом выше у мужчин и лиц старшего возраста [36, 37]. IgG4 не активирует комплемент, имеет сниженные эффекторные свойства по сравнению с другими подклассами IgG. Синтез IgG4 частично стимулируется Тh2-зависимыми цитокинами. Известно, что этот подкласс иммуноглобулинов, наряду с IgE, играет значительную роль в патогенезе атопических процессов (бронхиальная астма, атопическая экзема, буллезный дерматит). С другой стороны, описан защитный механизм действия IgG4, препятствующий эффективному связыванию IgE с аллергеном [37, 38].
Взаимосвязь IgG4 и ЭоЭ
Впервые патологическое содержание IgG4 при иммуногистохимическом анализе биоптатов слизистой оболочки пищевода пациентов с ЭоЭ описали Frederic Clayton, John C. Fang, Gerald J. Gleich в своем исследовании — «Эозинофильный эзофагит у взрослых ассоциирован с IgG4, а не с IgE-ответом» [27]. Авторы отмечают схожесть патогенеза ЭоЭ и IgG4-связанных заболеваний. Эозинофильный эзофагит как и IgG4-CЗ реагирует на стероиды, эти заболевания связаны с атопией, эозинофильными инфильтратами, многочисленными плазматическими клетками, гранулярными скоплениями IgG4, фиброзом и преобладают у мужчин [27, 39, 40]. Но между ними присутствуют и различия: типичные IgG4-связанные заболевания с поражением пищевода имеют отчетливую миофибробластную пролиферацию, стриктуры и нередко облитерирующий флебит [27, 41]. Общий сывороточный IgG4 минимально увеличивается при эозинофильном эзофагите, в отличие IgG4-СЗ. Учитывая эти различия, коллектив авторов называет эозинофильный эзофагит IgG4-ассоциированным состоянием, а не IgG4-СЗ [27]. Исследователи предположили, что активация IgG4 следует за IgE-опосредованным ответом, блокируя вызванную им реакцию активации тучных клеток, т.е. выполняет защитную реакцию [27, 39]. Вторым этапом данного исследования было изучение влияния терапии омализумабом (моноклональные АТ к IgE) на течение ЭоЭ у взрослых пациентов. Данное проспективное исследование продемонстрировало, что омализумаб не уменьшал симптомы ЭоЭ и количества эозинофилов в тканях по сравнению с плацебо, что еще раз подтверждает неIgE-индуцированный ответ на триггерные факторы воспаления [27].
В 2016 году Zukerberg L. с соавторами провел исследование роли IgG4-ответа у пациентов с ЭоЭ и гастроэзофагеальной рефлюксной болезни (ГЭРБ) [42]. Было выявлено, что у пациентов с рефлюкс-эзофагитом также имеется повышение IgG4-плазматических клеток и депозитов IgG4 в собственной пластинке, что позволяет предположить, что эти два заболевания тесно связаны, и патологический каскад воспалительных реакций может быть сходным [42-44]. ГЭРБ может служить дополнительным фактором в патогенезе ЭоЭ, способствуя более глубокому проникновению антигенов через поврежденную кислотно-пептическим рефлюктатом слизистую оболочку пищевода. Наличие кислого рефлюкса усиливает степень эозинофильной инфильтрации слизистой пищевода, способствует высвобождению мастоцитами медиаторов воспаления, а расширение межклеточных пространств при ГЭРБ приводит к взаимодействию антигенпрезентирующих клеток с аллергенами [42]. Поэтому значительная доля пациентов с клиническими и гистопатологическими особенностями, характерными для ЭоЭ, отвечает на антисекреторную терапию клиническим улучшением и уменьшением степени эозинофильной инфильтрации слизистой оболочки пищевода [42, 45]. Но у пациентов с ЭоЭ по сравнению с больными с рефлюкс-эзофагитом присутствуют интраэпителиальные депозиты IgG4, что может являться специфическим маркером именно этого заболевания [42,44].
Еще одно крупное исследование 2018 года Rosenberg CE с соавторами показывает роль IgG4-ответа в патогенезе ЭоЭ [46]. В работе продемонстрировано, что содержание IgG4 коррелирует со степенью активности и длительностью заболевания, патогенетическая роль в индукции экспрессии IgG4 принадлежит ИЛ-10, концентрация которого также зависит от активности ЭоЭ. Исследователи сходятся во мнении, что IgG4 и другие не-IgE-антитела функционируют как блокирующие антитела, ингибирующие активацию тучных клеток или базофилов [46]. В настоящее время продолжается проспективное наблюдение за данной когортой пациентов с ЭоЭ, сравнение клинической, эндоскопической, гистологической, иммуногистохимической картины и сывороточных IgG, что, возможно, в будущем позволит более детально изучить патогенетические аспекты данного заболевания и персонифицировать терапию.
Биоптаты из слизистой пищевода нашего пациента представлен грубой волокнисто-фиброзной тканью с выраженной диффузно-очаговой инфильтрацией плазматических клеток, которая местами напоминала опухолеподобный характер на фоне массивного фиброза и реактивных изменений краевого плоского эпителия, что привело к гипердиагностике интраэпителиальной неоплазии низкой степени. Пересмотр гистологического материала с иммунногистохическим исследованием позволил провести дифференциальную диагностику выявленных патологических изменений. Весь клеточный массив был представлен CD138±клетками, экспрессирующими IgG4 и IgG4+/IgG+ соотношение >40%, что позволило расценить патологический процесс, как IgG4-связанное заболевание [12]. В настоящее время в доступной литературе описаны единичные клинические случаи IgG4-связанного поражения пищевода.
Наличие у пациента, описанного в этой статье, дисфагии, рецидивирующего эрозивно-язвенного повреждения слизистой, стеноза пищевода и морфологического заключения биоптатов пищевода, позволяет критериально диагностировать IgG4-связанный эзофагит и ЭоЭ. От появления симптомов в 3-х летнем возрасте до постановки диагноза прошло 14 лет, что подчеркивает не только объективные сложности, но расширение методических подходов и новых знаний по изучаемой проблеме.
В 2017 году в США I. Obiorah, A. Hussain с соавторами описали восемь случаев клинико-морфологического наблюдения IgG4-связанного эзофагита [47]. Исследователи ретроспективно оценили патофизиологические аспекты пациентов, у которых был диагностирован IgG4-связанный эзофагит, сравнили клиническую, морфологическую и иммунногистохимическую картину с группой сравнения — пациентами с диагнозом хронический эзофагит, которые также имели лимфоплазмоцитарную инфильтрацию и изъязвление слизистой оболочки, но по гистологическим критериям не являлись IgG4-CЗ. Диагностические критерии IgG4-связанного эзофагита включали наличие IgG4±клеток и два из трех основных критериев IgG4-CЗ: интенсивное лимфоплазмацитарное воспаление, облитерирующий флебит и фибросклероз. Иммуногистохимические критерии: наличие ≥50 IgG4-позитивных плазматических клеток при большом увеличении и IgG4/ IgG ≥ 50%. Пациенты c IgG4-СЗ пищевода была представлены семью мужчинами и одной женщиной, средний возраст составил 54,7 ± 16,4 года. Большинство пациентов предъявляли жалобы на дисфагию и симптомы ГЭРБ (изжогу, регургитацию, одинофагию). При контрольных ЭГДС трем пациентам описывали рецидивирующие стриктуры пищевода с отечной рыхлой слизистой оболочкой, двум из них в анамнезе была выполнена баллонная дилатация пищевода, миотомия Хеллера. У остальных пациентов описывали хронический эрозивный эзофагит разной степени выраженности. Всем пациентам выполнена мультифокальная биопсия слизистой. У одного пациента в биоптате также диагностировано более 50 эозинофилов в поле зрения при большом увеличении, которое авторы расценили как IgG4-СЗ пищевода, ассоциированное с эозинофильным эзофагитом. Продолжительность от начала симптомов до постановки окончательного диагноза варьировала у больных от 3 месяцев до 20 лет. Уровни IgG4 в сыворотке измеряли только у трех пациентов с рецидивирующими стриктурами, все они имели референсные значения. При сравнении с контрольной группой пациенты с IgG4-связанным эзофагитом имели более высокую плотность лимфоплазмоцитарных инфильтратов. У трех пациентов с IgG4-СЗ пищевода диагностирован облитерирующий флебит, в то время как ни один из пациентов в контрольной группе не имел данного патогномоничного признака. Среднее количество IgG4-позитивных плазматических клеток в группе IgG4-СЗ пищевода было 66,9 ± 21,9 и среднее соотношение IgG4:IgG составляло 0,76 ± 0,13, оба параметра были значительно выше (р≤ 0,001) чем в контрольной группе [47].
После верификации диагноза всем пациентам с IgG4-СЗ пищевода была назначена стероидная терапия (преднизолон 0,6 мг/кг/сут), которая показала хороший клинический и гистологический эффект при других IgG4-СЗ. Предыдущие исследования определили частоту рецидивов от 24% до 63% с высокой частотой неполного ответа на стероидную терапию [48-50]. Долгосрочная поддерживающая терапия низкими дозами ГК может быть назначена для пациентов с высоким риском рецидива [49]. При неэффективности стероидов может рассматриваться у таких пациентов иммуносупрессивная терапия, например, метотрексатом [51-53]. На иммуносупрессивной терапии отмечалось уменьшение клинической симптоматики, но в исследованиях не было продемонстрировано значительного эффекта по сравнению с плацебо [53]. У двух пациентов в исследовании был хороший первоначальный ответ на стероиды, но позже развились рецидивы и стриктуры пищевода. При неэффективности стероидной или иммунносупрессивной терапии, в настоящее время, у пациентов с IgG4-СЗ проходят рандомизированные плацебо-контролируемые исследование по применению моноклональных антител, обладающих специфичностью к CD20 антигену — ритуксимаба. Несколько исследований продемонстрировали, что пациенты с IgG4-связанным заболеванием показали значительное клиническое и серологическое улучшение после лечения ритуксимабом [51,52]. Использование ритуксимаба при заболеваниях, связанных с IgG4-ответом, требует дальнейшего изучения в условиях клинических испытаний. В связи с чем, авторы данного исследования рекомендуют всем пациентам с дисфагией и рецидивирующими стриктурами пищевода на фоне эрозивно-язвенного повреждения проводить множественную биопсию пищевода и иммунногистохимическое исследование для верификации IgG4-СЗ пищевода, что поможет предотвратить необоснованную эзофагэктомию, а вовремя назначенная патогенетическая медикаментозная терапия может снизить потребность во множественных эндоскопических дилатациях пищевода.
С учетом отсутствия данных о тактике ведения пациентов с коморбидным поражением пищевода — эозинофильным эзофагитом и IgG4-связанным заболеванием пищевода мы назначили глюкокортикостероиды (схема назначения представлена выше), ИПП и эзофагопротектор — Альфазокс. Это медицинское изделие состоит из смеси низкомолекулярной (80-100 кДа) гиалуроновой кислоты и низкомолекулярного (10-20 кДа) хондроитина сульфата, растворенных в биоадгезивном носителе (полоксамер 407) [54]. Альфазокс обладает способностью фиксироваться на слизистой оболочке, благодаря чему реализует эффект механической защиты слизистой оболочки от повреждающего действия компонентов рефлюктата (соляной кислоты, пепсина и желчи) [54]. Гиалуроновая кислота, входящая в состав препарата, — это естественный полимер, участвующий в различных физиологических процессах, включая репарацию, регенерацию и морфогенез [55]. Биологическое значение гиалуроновой кислоты частично обусловлено ее гидрофильными и гидродинамическими свойствами, которые позволяют ей удерживать воду и играть структурирующую роль. Препараты гиалуроновой кислоты для топического применения предназначены для лечения рецидивирующих афтозных язв слизистой оболочки рта и обеспечивают быстрое облегчение симптомов, чему также может способствовать дозозависимое противовоспалительное действие данного соединения [56, 57]. Помимо этого, в экспериментальных исследованиях in vivo показана способность гиалуроновой кислоты индуцировать экспрессию белков плотных контактов ZO-1, что потенциально будет способствовать восстановлению барьерной функции эпителия [58]. Второй компонент Альфазокса — хондроитин сульфат — это естественный гликозаминогликан, обладает иммуномодулирующими, противовоспалительными и антиоксидантными свойствами [59, 60]. Являясь естественным компонентом защитного слоя слизи, хондроитина сульфат связывается с пепсином, ингибируя его [61-63]. Третий компонент Альфазокса, полоксамер 407, представляет собой гидрофильное неионное поверхностно активное вещество, обеспечивает пролонгированное высвобождение различных лекарственных форм [64]. Адгезивные свойства полоксамера 407 обеспечивают фиксацию комплекса гиалуроновой кислоты и хондроитина сульфата на слизистой пищевода в течение длительного времени. [65, 66].
Альфазокс оказывает свое действие на поверхности слизистой пищевода, не проникая в системный кровоток, а также обладает низким аллергенным потенциалом. В клинических исследованиях безопасность Альфазокса не отличалась от плацебо, аллергических реакций выявлено не было [67, 68].
Таким образом, Альфазокс оказывает заживляющее и восстанавливающее действие при эрозивных повреждениях эпителия пищевода [54]. Согласно результатам нескольких многоцентровых клинических исследований, комбинация Альфазокса и ИПП позволяла более эффективно добиться регрессии клинических проявлений заболевания и улучшения качества жизни пациентов (согласно опроснику SF36) по сравнению с монотерапией ИПП [67, 68]. За счет обеспечения Альфазоксом дополнительной защиты пищевода на преэпителиальном и эпителиальном уровнях, что способствует снижению воспаления и заживлению эрозивно-язвенных повреждений слизистой, мы считаем целесообразным его назначение при заболеваниях пищевода, в которых процессы воспаления являются важным патогенетическим звеном.
В настоящее время ЭоЭ не относится по спектру к IgG4-СЗ, но биологическая роль IgG4 в патогенезе эозинофильного эзофагита доказана. Показаны IgG4-опосредованный характер воспалительной реакции, корреляция активности заболевания и количества интраэпителиальных и межэпителиальных эозинофильных лейкоцитов и IgG4+ плазматических клеток. Наличие массивной инфильтрации IgG4+ слизистой оболочки пищевода является предиктором плохого ответа на терапию ИПП у пациентов с ЭоЭ, в связи с чем по аналогии с терапией IgG4-СЗ обсуждается целесообразность индукции ремиссии глюкокортикостероидами или биологической антицитокиновой терапией. Отсутствие проспективных контролируемых клинических исследований, посвященных данной проблематике, не позволяет выявить клинические особенности IgG4-СЗ пищевода и рассматривать терапию такую с позиции доказательной медицины.
Таким образом, связь между IgG4-связанной патологией и эозинофильным эзофагитом еще предстоит изучать. Необходимы дальнейшие исследования, направленные на определение клинической значимости IgG4 в качестве биомаркера и его специфичности при ЭоЭ, а также работы, посвященные IgG4-СЗ пищевода и коморбидности этих состояний [46]. Выяснение точных патофизиологических механизмов позволит разработать новые диагностические и терапевтические подходы.
1. Трухманов А.С., Ивашкина Н.Ю. Эозинофильный эзофагит. В кн. Ивашкин В.Т. (ред.) Рациональная фармакотерапия заболеваний органов пищеварения. 2-е изд. М.: Литерра, 2011.
2. Lucendo A.J., Molina-Infante J., Arias Á. et al. Guidelines on eosinophilic esophagitis: evidence-based statements and recommendations for diagnosis and management in children and adults. United European Gastroenterol J. 2017;5(3):335—58. DOI: 10.1177/2050640616689525.
3. Dellon E.S., Gonsalves N., Hirano I. et al. ACG clinical guideline: evidenced based approach to the diagnosis and management of esophageal eosinophilia and eosinophilic esophagitis. Am J Gastroenterol. 2013;108:679—92.
4. В.Т. Ивашкин, И.В. Маев, А.С. Трухманов, Т.Л. Лапина Клинические рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению эозинофильного эзофагита. Рос журн гастроэнтерол гепатол колопроктол 2018; 28(6). Doi: 10.22416/1382-4376-2018-28-6-84-98.
5. Hirano I., Chan E.S., Rank M.A. et al. AGA Institute and the Joint Task Force on Allergy-Immunology Practice Parameters Clinical Guidelines for the Management of Eosinophilic Esophagitis. Gastroenterology. 2020;158:1776—1786. Doi: https://doi.org/10.1053/j.gastro.2020.02.038.
6. O’Shea KM, Aceves SS, Dellon ES, Gupta SK, Spergel JM, Furuta GT, Rothenberg ME. Pathophysiology of Eosinophilic Esophagitis. Gastroenterology. 2018 Jan;154(2):333-345. https://doi.org/10.1053/j.gastro.2017.06.065.
7. Arias A, Perez-Martinez I, Tenias JM, Lucendo AJ. Systematic review with meta- analysis: the incidence and prevalence of eosinophilic oesophagitis in children and adults in population-based studies. Aliment Pharmacol Ther. 2016;43:3-15. https://doi.org/10.1111/apt.13441.
8. Dellon ES, Hirano I. Epidemiology and Natural History of Eosinophilic Esophagitis. Gastroenterology. 2018;154(2):319-332. https://doi.org/10.1053/j.gastro.2017.06.06.
9. Кайбышева В.О., Эрдес С.И., Кашин С. В. и др. Эозинофильный эзофагит: собственный опыт диагностики и лечения. Экспериментальная и клиническая гастроэнтерология. 2018;158(10).
10. Straumann A, Katzka DA. Diagnosis and Treatment of Eosinophilic Esophagitis. Gastroenterology.2018Jan;154(2):346-359. ttps://doi.org/10.1053/j.gastro.2017.05.066
11. Collins MH, Martin LJ, Alexander ES et al. Newly developed and validated eosinophilic esophagitis histology scoring system and evidence that it outperforms peak eosinophil count for disease diagnosis and monitoring. Dis Esophagus. 2016. https://doi.org/10.1111/dote.12470.
12. Khan, S., Zhu, L., Jiang, K., Liu, W. et al. Immunoglobulin G4-Related Disease Manifesting as Isolated, Typical and Nontypical Gastroesophageal Lesion: A Research of Literature Review. Digestion, 2019, 1–16. doi:10.1159/000501513
13. Ивашкин В.Т., Баранская Е.К., Кайбышева В.О., Трухманов А.С., Шептулин А.А. Клинические рекомендации по диагностике и лечению эозинофильного эзофагита. М. 2013
14. Vinit C., A. Dieme A., Courbage S. et al. Eosinophilic esophagitis: Pathophysiology, diagnosis, and management. Archives de Pédiatrie, 2019; 26 (3): 182-190. https://doi.org/10.1016/j.arcped.2019.02.005.
15. Rothenberg M. Molecular, Genetic, and Cellular Bases for Treating Eosinophilic Esophagitis. Gastroenterology; 2015; 148 (6): 1143-1157. https://doi.org/10.1053/j.gastro.2015.02.002
16. Lucendo AJ, Molina-Infante J, Arias Á. Et al. Guidelines on eosinophilic esophagitis: evidence-based statements and recommendations for diagnosis and management in children and adults. United European Gastroenterol J. 2017;5(3):335-358. https://doi.org/10.1177/2050640616689525.
17. Brown-Whitehorn TF, Spergel JM. The link between allergies and eosinophilic esophagitis: implications for management strategies. Expert Rev Clin Immunol 2010;6:101—9.
18. Blanchard C, Wang N, Rothenberg ME. Eosinophilic esophagitis: pathogenesis, genetics, and therapy. J Allergy Clin Immunol 2006;118:1054—9.
19. Sherrill JD, Rothenberg ME. Genetic dissection of eosinophilic esophagitis provides insight into disease pathogenesis and treatment strategies. J Allergy Clin Immunol 2011;128:23—32.
20. Cianferoni A., Spergel J.M., Muir A. Recent advances in the pathological understanding of eosinophilic esophagitis. Expert Rev Gastroenterol Hepatol. 2015;9(12):1501—10. DOI: 10.1586/17474124.2015.1094372
21. Hill D.A., Spergel J.M. The Immunologic Mechanisms of Eosinophilic Esophagitis. Curr Allergy Asthma Rep. 2016;16(2):9. DOI: 10.1007/s11882-015-0592-3
22. Spergel J.M. New genetic links in eosinophilic esophagitis. Genome Med. 2010;2(9):60.
23. Blanchard C, Mingler MK, Vicario M, et al. IL-13 involvement in eosinophilic esophagitis: transcriptome analysis and reversibility with glucocorticoids. J Allergy Clin Immunol 2007;120:1292—300.
24. Mishra A, Rothenberg ME. Intratracheal IL-13 induces eosinophilic esophagitis by an IL-5, eotaxin-1, and STAT6-dependent mechanism. Gastroenterology 2003, 125:1419-1427.
25. Blanchard C, Wang N, Stringer KF et al. Eotaxin-3 and a uniquely conserved gene-expression profile in eosinophilic esophagitis. J Clin Invest 2006, 116:536-547.
26. Straumann A, Bauer M, Fischer B, Blaser K, Simon HU: Idiopathic eosinophilic esophagitis is associated with a T(H)2-type allergic inflammatory response. J Allergy Clin Immunol 2001, 108:954-961.
27. Clayton F, Fang JC, Gleich GJ, Lucendo AJ, Olalla JM, Vinson LA, et al. Eosinophilic esophagitis in adults is associated with IgG4 and not mediated by IgE. Gastroenterology 2014;147(3):602-609.
28. Aalberse RC, Platts-Mills TA, Rispens T. The Developmental History of IgE and IgG4 Antibodies in Relation to Atopy, Eosinophilic Esophagitis, and the Modified TH2 Response. Curr Allergy Asthma Rep 2016;16(6):45.
29. Wright BL, Kulis MD, Guo R, Orgel K, Wolf WA, Burks AW, et al. Food-Specific IgG4 Is Associated with Eosinophilic Esophagitis. J Allergy Clin Immunol 2016;137(2):Ab232Ab232.
30. Smyrk T C. Pathological features of IgG4-related sclerosing disease. Curr Opin Rheumatol 2011; 23: 74–9.
31. Khosroshahi A, Deshpande V, Stone J H. The clinical and pathological features of IgG(4)-related disease. Curr Rheumatol Rep 2011; 13: 473–81.
32. Kamisawa T, Funata N, Hayashi Y et al. A new clinicopathological entity of IgG4-related autoimmune disease. J Gastroenterol 2003; 38: 982–4
33. Koyabu M., Uchida K., Miyoshi H. et al. Analysis of regulatory T-cells and IgG4-positive plasma cells among patients of IgG4-related sclerosing cholangitis and autoimmune liver diseases. J. Gastroenterol. 2010; 45: 732–741.
34. Tanaka A., Moriyama M., Nakashima H. et al. Th2 and regulatory immune reactions contributes to IgG4 production and the initiation of Mikulicz’s disease. Arthritis Rheum. 2012; 64: 254–263.
35. Deshpande V. IgG4-Related Disease of the Gastrointestinal Tract: A 21st Century Chameleon. Arch Pathol Lab Med. 2015;139(6):742—9
36. Буеверов А.О., Кучерявый Ю.А. IgG4-ассоциированная болезнь: монография. М.: Форте Принт, 2014:128 с.
37. Stone JH, Zen Y, Deshpande V. IgG4-related disease. N Engl J Med. 2012; 366(6): 539–51.
38. Davies AM, Sutton BJ. Human IgG4: a structural perspective. Immunol Rev 2015;268(1):139-159.
39. Lee H, Joo M, Song TJ, Chang SH, Kim H, Kim YS, et al. IgG4-related sclerosing esophagitis: a case report. Gastrointest Endosc. 2011;73(4):834—7.
40. Lopes J, Hochwald SN, Lancia N, Dixon LR, Ben-David K. Autoimmune esophagitis: IgG4-related tumors of the esophagus. J Gastrointest Surg. 2010; 14(6):1031—4.
41. Oh JH, Lee TH, Kim HS, Jung CS, Lee JS et al. Esophageal Involvement of Immunoglobulin G4-Related Disease: A Case Report and Literature Review. Medicine (Baltimore). 2015 Dec;94(50):e2122.
42. Zukerberg L, Mahadevan K, Selig M. Oesophageal intrasquamous IgG4 deposits: an adjunctive marker to distinguish eosinophilic oesophagitis from reflux oesophagitis. Histopathology. 2016; 68, 968–976. DOI: 10.1111/his.12892.
43. Parfitt JR, Gregor JC, Suskin NG, Jawa HA, Driman DK. Eosinophilic esophagitis in adults: distinguishing features from gastroesophageal reflux disease: a study of 41 patients. Mod. Pathol. 2006; 19; 90 —96.
44. Collins MH. Histopathologic features of eosinophilic esophagitis and eosinophilic gastrointestinal diseases. Gastroenterol. Clin. North Am. 2014; 43; 257–268.
45. Wen T, Dellon ES, Moawad FJ, Furuta GT, Aceves SS, Rothenberg ME. Transcriptome analysis of proton pump inhibitorresponsive esophageal eosinophilia reveals proton pump inhibitor-reversible allergic inflammation. J. Allergy Clin. Immunol. 2015; 135; 187–197.
46. Rosenberg, C. E., Mingler, M. K., Caldwell, J. M., Collins, M. H. et al. Esophageal IgG4 levels correlate with histopathologic and transcriptomic features in eosinophilic esophagitis. Allergy. 2018; 73(9):1892-1901. doi:10.1111/all.13486.doi:10.1111/all.13486
47. Obiorah I., Hussain A., Palese C., Azumi N. IgG4-related disease involving the esophagus: a clinicopathological study. Diseases of the Esophagus (2017) 30, 1–7. DOI: 10.1093/dote/dox091
48. Martinez-Valle F, Fernandez-Codina A, Pinal-Fernandez I,Orozco-Galvez O, Vilardell-Tarres M. IgG4-related disease: evidence from six recent cohorts. Autoimmun Rev 2016; 15: 30274–9.
49. Brito-Zeron P, Bosch X, Ramos-Casals M, Stone J H. IgG4-related disease: advances in the diagnosis and treatment. Best Pract ResClin Rheumatol 2016; 30: 261–78.
50. Kamisawa T, Okazaki K, Kawa S, Shimosegawa T, Tanaka M. Japanese consensus guidelines for management of autoimmune pancreatitis: III. Treatment and prognosis of AIP. J Gastroenterol 2010; 45: 471–7.
51. Khosroshahi A, Bloch D B, Deshpande V, Stone J H. Rituximab therapy leads to rapid decline of serum IgG4 levels and prompt clinical improvement in IgG4-related systemic disease. Arthritis Rheum 2010; 62: 1755–62.
52. Carruthers M N, Topazian M D, Khosroshahi A et al. Rituximab for IgG4-related disease: a prospective, open-label trial. Ann Rheum Dis 2015; 74: 1171–7.
53. Della-Torre E, Campochiaro C, Bozzolo E P et al. Methotrexate for maintenance of remission in IgG4-related disease. Rheumatology 2015; 54: 1934–6.
54. Savarino E, Zentilin P, Marabotto E, Pellegatta G, Coppo C, Brunacci M, Dulbecco P, Savarino V. Drugs for improving esophageal mucosa defense: where are we now and where are we going? Ann Gastroenterol. 2017;30(6):585-591. doi: 10.20524/aog.2017.0187.
55. Gaffney J, Matou-Nasri S, Grau-Olivares M, Slevin M. Therapeutic applications of hyaluronan. Mol Biosyst. 2010 Mar; 6(3):437-43.
56. Ialenti A, Di Rosa M. Hyaluronic acid modulates acute and chronic inflammation. Agents Actions. 1994 Nov; 43(1-2):44-7.
57. Nolan A, Baillie C, Badminton J, Rudralingham M, Seymour RA. The efficacy of topical hyaluronic acid in the management of recurrent aphthous ulceration. J Oral Pathol Med 2006; 35: 461–5
58. Kim Y, Kessler SP, Obery DR, Homer CR, McDonald C, de la Motte CA. Hyaluronan 35kDa treatment protects mice from Citrobacter rodentium infection and induces epithelial tight junction protein ZO-1 in vivo. Matrix Biol. 2017 Oct;62:28-39. doi: 10.1016/j.matbio.2016.11.001.
59. Volpi N. Anti-inflammatory activity of chondroitin sulphate: new functions from an old natural macromolecule. Inflammopharmacology. 2011 Dec; 19(6):299-306.
60. Souich P, Garcia AG, Verges J, Montell E. Immunomodulatory and anti‐inflammatory effects of chondroitin sulphate. J Cell Mol Med 2009; 13: 1451–63.
61. Bonfils S, Dubrasquet M, Lambling A. The inhibition of peptic proteolysis by various polysaccharides. Rev Fr Etud Clin Biol 1960; 5: 71–4.
62. Galzigna L, Previerocoletti MA. Action of sodium chondroitin sulfate on the enzymatic activity of pepsin. Gazz Med Ital 1965; 124: 65–7.
63. Lenzi G, Rapino P, Ferri S. On the behavior of gastric hydrochloric and peptic activity after administration of sodium chondroitin sulfate. Minerva Med 1963; 54: 3421–4.
64. Ramya Devi D, Sandhya P, Vedha Hari BN. Poloxamer: a novel functional molecule for drug delivery and gene therapy. J Pharm Sci Res. 2013;5:159—165.
65. Dumortier G, Grossiord JL, Agnely F, Chaumeil JC. A review of poloxamer 407 pharmaceutical and pharmacological characteristics. Pharm Res. 2006 Dec; 23(12):2709-28.
66. Palmieri B, Corbascio D, Capone S, Lodi D. Preliminary clinical experience with a new natural compound in the treatment of esophagitis and gastritis: symptomatic effect. Trends Med. 2009;9:219—225.
67. Palmieri B, Merighi A, Corbascio D, Rottigni V, Fistetto G, Esposito A. Fixed combination of hyaluronic acid and chondroitin-sulphate oral formulation in a randomized double blind, placebo controlled study for the treatment of symptoms in patients with non-erosive gastroesophageal reflux. Eur Rev Med Pharmacol Sci. 2013;17:3272—3278.
68. Savarino V, Pace F, Scarpignato C, Esoxx Study Group Randomised clinical trial: mucosal protection combined with acid suppression in the treatment of non-erosive reflux disease — efficacy of Esoxx, a hyaluronic acid-chondroitin sulphate based bioadhesive formulation. Aliment Pharmacol Ther. 2017;45:631—642.







