Ряд исследований показал, что пациенты с неэрозивной рефлюксной болезнью (НЭРБ) менее восприимчивы к ингибиторам протонного насоса (ИПН), чем пациенты с эрозивной болезнью, поскольку они принадлежат к различным подгруппам с симптомами, вызванными разными факторами, помимо кислоты.
Цель
Оценить, усиливает ли комбинированная терапия (защита слизистой оболочки и подавление кислоты) облегчение симптомов по сравнению с монотерапией ИПН.
Методы
В многоцентровое рандомизированное двойное слепое исследование рандомизировали 154 пациента с НЭРБ для приема медицинского изделия Альфазокс (Альфасигма С.п.А., Италия), биоадгезивного препарата на основе гиалуроновой кислоты и хондроитина сульфата, или плацебо в комбинации с подавлением кислоты при помощи стандартной дозы ИПН в течение 2 недель. Симптомы (изжога, кислая отрыжка, боль за грудиной и кислый привкус во рту) и связанное со здоровьем качество жизни (СЗКЖ) оценили перед началом терапии и после нее. Первичной конечной точкой была доля пациентов со снижением общей оценки симптомов не менее чем на 3 балла.
Результаты
В конце терапии первичной конечной точки достигли 52,6% пациентов, принимавших Альфазокс, по сравнению с 32,1% пациентов, принимавших плацебо (P <0,01). Аналогично оценка СЗКЖ по краткому опроснику-36 улучшилась в обеих группах терапии, но некоторые параметры были значительно лучше после комбинированной терапии Альфазокс + ИПН.
Вывод
Синергический эффект комбинированной терапии Альфазоксом + ИПН свидетель-ствует о том, что защита слизистой оболочки в комбинации с подавлением кислоты может облегчить симптомы и улучшить СЗКЖ у пациентов с НЭРБ.
Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) — это распространенное в западных странах расстройство, основной симптом которого — изжога — может возникать раз в неделю у 26% популяции.1 Несмотря на географические вариации, уровень заболеваемости ГЭРБ в мире возрастает.
В последнее десятилетие было обнаружено, что существует два различных фенотипа заболевания. У некоторых пациентов присутствуют очаги поражения слизистой оболочки пищевода (т.е. эрозивный эзофагит), но у большинства (до 70%) по данным эндоскопии макроскопические нарушения слизистой оболочки отсутствуют. У данных пациентов, как правило, диагностируют неэрозивную рефлюксную болезнь (НЭРБ).2-4
Ингибиторы протонного насоса (ИПН) — это препараты первого выбора в лечении ГЭРБ,5 они обеспечивают уровень восстановления очагов поражения пищевода, включая язвы, до 80–85%, а также снижают частоту осложнений. Объединенные анализы6,7 показали, что в 56-76% случаев можно достичь облегчения симптомов, несмотря на сниженную пользу для пациентов с НЭРБ. Согласно широко цитируемому систематическому обзору,7 у пациентов с НЭРБ по сравнению с пациентами с эрозивным эзофагитом облегчение симптомов при приеме ИПН менее выражено, а терапевтическая эффективность снижена приблизительно на 20%. Обширное исследование AGA8 показало, что несмотря на использование ИПН более чем у 55% пациентов с симптомами ГЭРБ (при неэрозивном и эрозивном заболевании) наблюдается снижение качества жизни. Недавние исследования показали, что не только кислый, но и некислый рефлюкс может вызывать гистопатологические изменения, подтвержденные при помощи электронной и световой микроскопии у большинства пациентов с НЭРБ.9-11, в частности, расширение межклеточного пространства между прилегающими клетками эпителия пищевода является отличительной чертой микроскопического эзофагита. Это межклеточное пространство приводит к повышению проницаемости, что способствует проникновению ионов водорода и других веществ (включая пепсин и желчь) в подслизистый слой пищевода, где они стимулируют нервные волокна, вызывая типичный симптом изжоги. В нескольких исследованиях12 продемонстрировано синергическое действие кислоты и дуоденогастрального рефлюкса в развитии очагов поражения. Подтверждена важная роль пепсина в патогенезе внепищеводных проявлений ГЭРБ.13
Оптимальная терапия пациентов с НЭРБ должна быть направлена не только на подавление секреции кислоты, но и на указанные патофизиологические характеристики, которые являются барьером для и/или связывают остаточные агрессивные компоненты рефлюксата (т.е. слабо-кислое содержимое и пепсин), стимулируя восстановление слизистой оболочки. Для достижения этих целей было специально разработано медицинское изделие III класса Альфазокс (Альфасигма С.п.А., Италия).14,15 Оно состоит из смеси (в соотношении 1:2,5) низкомолекулярной (80-100 кДа) гиалуроновой кислоты и низкомолекулярного (10-20 кДа) хондроитина сульфата, растворенного в биоадгезивном носителе (полоксамер 407) для формирования макромолекулярного комплекса, обволакивающего слизистую оболочку пищевода и выступающего в качестве механического барьера в отношении вредных компонентов рефлюксата. Время транзита жидкости через пищевод очень ограничено (менее 16 с) даже в положении лежа.16 Вязкий состав, обволакивающий слизистую оболочку, ограничивает контакт рефлюксной кислоты и пепсина с поверхностью эпителия17 и может выступать в качестве носителя для доставки лекарственных препаратов местного действия в пищеводе.18
Компоненты Альфазокса — это два хорошо известных физиологических вещества. Гиалуроновая кислота — это распространенное биологически активное вещество, регулирующее клеточную функцию за счет взаимодействия с определенными рецепторами.19 Это многофункциональный высокомолекулярный гликозаминогликан, компонент большинства внеклеточных матриксов, участвующий в различных ключевых физиологических процессах, включая восстановление ран и регенерацию, морфогенез и организацию матрикса.20 Биологическая роль гиалуроновой кислоты частично обусловлена ее гидрофильными и гидродинамическими свойствами, которые позволяют ей удерживать воду и играть структурирующую роль. Гидрогели (поперечно связанные гидрофильные полимеры) используют в качестве скаффолдов для восстановления или регенерации тканей в местах повреждения, после чего они распадаются под действием ферментов ткани.19 Низкомолекулярная гиалуроновая кислота является проангиогенной, она стимулирует формирование новых кровеносных сосудов и активирует путь передачи сигнала, что приводит к пролиферации и миграции эндотелиальных клеток. В свою очередь нативная высокомолекулярная гиалуроновая кислота является антиангиогенной и подавляет формирование кровеносных сосудов.19 Препараты гиалуроновой кислоты для местного применения предназначены для лечения рецидивирующих афтозных язв слизистой оболочки рта21,22 и обеспечивают быстрое облегчение симптомов, чему также может способствовать дозозависимое противовоспалительное действие данного соединения23.
Хондроитин сульфат — это естественный гликозаминогликан, который присутствует в окружающем клетки внеклеточном матриксе, в особенности в хрящах, коже, кровеносных сосудах, связках и сухожилиях, где он формирует важный компонент протеогликанов.24 Имеющиеся данные свидетельствуют, что хондроитин сульфат выполняет важную биологическую функцию в воспалительных процессах, пролиферации, дифференциации, миграции клеток, морфогенезе тканей, органогенезе, инфекционных процессах и заживлении ран.25 Данное действие связано со способностью хондроитина сульфата взаимодействовать с различными молекулами, включая в том числе молекулы матрикса, факторы роста, ингибиторы протеазы, цитокины, хемокины и адгезивные молекулы за счет неспецифичных/специфичных сахаридных доменов внутри цепей.25 Данное соединение обладает иммуномодулирующими,26 противовоспалительными25,26 и антиоксидантными27 свойствами. Помимо неспецифичных взаимодействий хондроитин сульфат может специфически связываться с биоактивными молекулами, например, с пепсином. Пептическая активность снижается in vitro28 и in vivo,29,30 ранее предпринимались попытки лечения язвы желудка и двенадцатиперстной кишки при помощи хондроитина сульфата.31 Полоксамер 407 (блоки этиленоксида и пропиленоксида) — это гидрофильное неионное поверхностно активное вещество, обладающее термообратимыми свойствами, которое используют для оптимизации рецептуры лекарственных препаратов (находится в жидком состоянии при комнатной температуре, что облегчает введение, и в гелеобразном состоянии при переходе золя в гель при температуре тела, что обеспечивает пролонгированное высвобождение фар- макологических соединений).32
Формулы, содержащие полоксамер 407, помогают увеличить растворимость плохо растворимых в воде лекарственных препаратов и обеспечивает пролонгированное высвобождение различных лекарственных форм.33 Адгезивные свойства полоксамера 407 используют для увеличения времени удерживания препаратов в желудочно-кишечном тракте. Хорошая адгезия в пищеводе и выраженная диффузия лекарственного препарата в слизистой оболочке наблюдалась у мышей при помощи оптоволоконного спектрофлуорометрического метода.32
Согласно Директиве Европейского совета 93/42/ EEC,34 Национальный институт здравоохранения в Риме классифицировал данный биоадгезивный состав как медицинское изделие III класса, предназначенное для медицинского применения с целью лечения или облегчения заболевания. Как правило, функция медицинского изделия достигается физическим образом (включая механическое действие, физический барьер, замену или поддержание органов, или функций организма).
Экспериментальное исследование ex vivo на модели свиней показало, что перфузия данного медицинского изделия в просвете пищевода может предотвратить повышение проницаемости слизистой оболочки под действием кислоты и/или пепсина.35 С учетом этих данных два двойных слепых плацебо-контролируемых исследования продемонстрировали, что краткосрочное применение Альфазокса позволяет достичь существенного и быстрого облегчения симптомов у пациентов с эрозивной и неэрозивной рефлюксной болезнью.37 В данном проспективном двойном слепом плацебо-контролируемом исследовании оценили эффективность и безопасность Альфазокса в комбинации с подавлением кислоты, а также самостоятельное подавление кислоты у пациентов с НЭРБ, диагностированной как эндоскопически негативная рефлюксная болезнь.
Данная популяция отражает условия клинической практики вне специализированных центров, где недоступны дополнительные исследования.
В исследование включали пациентов с неэрозивной рефлюксной болезнью с типичными рефлюксными симптомами. Включали пациентов обоих полов в возрасте от 18 до 75 лет. Обязательным условием было наличие двух из следующих симптомов — изжога, кислая отрыжка, боль за грудиной и кислый привкус во рту — в течение не менее 3 месяцев и не реже трех раз в неделю в течение последнего месяца перед визитом скрининга. Диагноз НЭРБ основан на отсутствии макроскопических поражений слизистой оболочки дистальных отделов пищевода по данным эндоскопии,3,4 проведенной в течение 6 месяцев до визита скрининга, и оценке по валидированному опроснику (Опросник по рефлюксной болезни, RDQ)38 не менее 8 баллов.39 В соответствии с руководством NICE40 и во избежание влияния на уреазный экспресс-тест,41 который стандартно проводится во время эндоскопии, пациенты не должны были принимать антисекреторные препараты (ИПН или H2 блокаторы) в течение не менее 2 недель.
Критерии исключения: эрозивный эзофагит или синдром Баррета, язва желудка или двенадцатиперстной кишки, хирургическая операция на желудке или обширная операция на ЖКТ, атопия или непереносимость пищевых продуктов, заболевание щитовидной железы, диабет или метаболический синдром. Кроме того, исключали беременных, кормящих или фертильных женщин (не использующих методы контрацепции).
Дизайн исследования
Проведено многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование в параллельных группах. В исследовании участвовало шестнадцать итальянских больниц, каждая из которых получила одобрение соответствующего этического комитета.
Исследование проведено в соответствии с Международной конференцией по гармонизации требований к государственной регистрации лекарственных средств для медицинского применения (ICH), руководством по надлежащей клинической практике (GCP)42 и Хельсинкской декларацией (версия 1996г. в редакции от октября 2000г.).43
Пациенты, пригодные для участия в исследовании, подписывали форму информированного согласия, и вступали в 15-дневный (2 дня) вводный период/период отмывки, на время которого отменялась любая (рецептурная или безрецептурная) терапия (визит 1). В данный период разрешались только антациды или альгинатные препараты в случае развития симптомов. На визите 2 пациентов рандомизировали в последовательности, сгенерированной компьютером, в группу приема стандартной дозы ИПН (за 30 мин до завтрака) + 10 мл (1 упаковка) Альфазокс One (форма выпуска с однократной дозой) или плацебо (соответствующего вкуса и вязкости, упакованное в идентичный контейнер с порядковым номером) четыре раза в день через 1 ч после каждого приема пищи и перед сном в течение 14 дней. Порядок распределения определяла контрактная исследовательская организация LB Research, тогда как набор пациентов и назначение лечения осуществлял главный исследователь исследовательского центра (см. Приложение 1). Во время исследования каждый пациент заполнял дневник симптомов, в который он записывал наличие или отсутствие каждого симптома в течение дня и ночи. Перед коротким курсом терапии (визит 2) и после него (визит 3) оценивали частоту и степень тяжести НЭРБ при помощи опросника RDQ. Связанное со здоровьем качество жизни (СЗКЖ) оценивали при помощи опросника SF-36.44 Оба опросника заполняли врачи, которые не имели информации о назначенном лечении. Результаты по каждому параметру сравнивали с опубликованными данными в нормативной выборке для Италии.45 Также сравнили результаты до и после лечения по каждому параметру. Дизайн исследования и подробный график оценки представлены в Таблице S1.
Безопасность и переносимость оценили путем регистрации всех нежелательных явлений, определяемых как любые неблагоприятные или непредусмотренные симптомы и/или признаки, которые имеют причинно-следственную связь с исследуемыми лекарственными препаратами. Вкусовые качества оценивали после каждого приема лекарственного препарата по 4-балльной шкале (превосходно, хорошо, удовлетворительно и плохо). Таким образом, проведено 4 оценки в день х 15 дней для каждого пациента.
Приверженность пациентов определяли как процент использованного тестируемого препарата путем подсчета возвращенного лекарственного препарата на визите 3. Приверженность терапии от 80 до 120% считалась допустимой.
База данных европейских клинических исследований (EudraCT), созданная Европейским агентством по лекарственным препаратом (EMA), не включает клинические исследования медицинских изделий, но включает ссылку на процедуру в стране проведения клинического исследования. Протокол клинического исследования зарегистрирован (код протокола: Esoxx-NERD/001/2012) в Министерстве здравоохранения Италии, а регуляторные органы уведомлены о начале исследования (включение первого пациента) и завершении исследования (последняя оценка последнего включенного пациента).
Статистический анализ
Первичной конечной точкой был анализ эффективности терапии, рассчитанный как доля пациентов со снижением общей оценки симптомов (ООС) не менее чем на 3 балла. Данный расчет проводили путем сбора и подсчета данных по интенсивности симптомов у каждого пациента (на основании опросника RDQ на последнем визите) и сравнения с исходными значениями, полученными в конце вводного периода/периода отмывки (визит 2). Типичные симптомы оценивали по 5-балльной шкале Лайкерта 46: 0 = симптом отсутствует, 1 = симптом причиняет небольшое беспокойство, 2 = симптом причиняет беспокойство, 3 = симптом причиняет сильное беспокойство и мешает повседневной деятельности, 4 = непереносимый симптом, не позволяющий осуществлять повседневную деятельность.
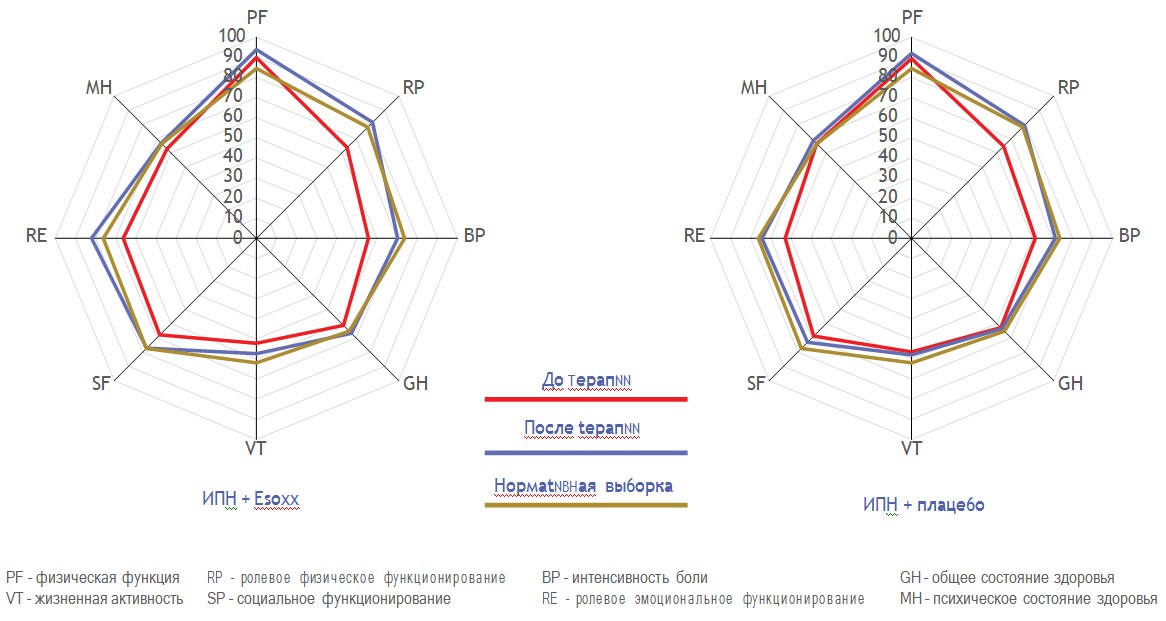
В исследовании было четыре различных вторичных конечных точки: (i) число пациентов с 50% снижением ООС на последнем визите, (ii) число пациентов со снижением ООС на последнем визите, (iii) изменение ООС после терапии и (iv) физические и психические параметры СЗКЖ согласно опроснику SF-36, рассчитанные при помощи веб-программы47 и представленные в виде лепестковых диаграмм или схем.48 Также оценили изменения степени тяжести и частоты каждого симптома (изжога, кислая отрыжка, боль за грудиной, кислый привкус во рту).
Популяция ITT включала всех рандомизированных пациентов, принявших хотя бы одну дозу лекарственного препарата, популяция по протоколу (РР) включала всех рандомизированных пациентов, завершивших терапию с приемлемой приверженностью и без нарушений протокола. Первую популяцию использовали для оценки первичной конечной точки, а последнюю для оценки первичной и вторичной конечных точек. Популяция для оценки безопасности включала всех рандомизированных пациентов, принявших хотя бы одну дозу исследуемых препаратов.
Для сравнения процентных значений для первичных и вторичных конечных точек использовали Хи-квадрат и точный критерий Фишера (двусторонний), при этом арифметические средние значения и частоту сравнивали при помощи 95% доверительных интервалов (ДИ).49 Все расчеты выполняли при помощи программного обеспечения PRISM 6.0 (GraphPad, San Diego, CA, США) для MAC.
Размер выборки рассчитали на основании снижения ООС НЭРБ на 3 балла на последнем визите с учетом 10% улучшения в группе плацебо и 30% в группе Альфазокса. Мощность исследования 80% и уровень значимости ≤0,05 (двусторонний точный критерий Фишера) соответствуют размеру выборки из 70 пациентов на группу. С учетом 12% пациентов, не подлежащих оценке, размер выборки увеличили до 80 пациентов. Расчет проводили при помощи программы STATA (версия 13, StataCorp LP, College Station, TX, США) для MAC.
В 16 исследовательских центрах скринировали 172 пациента с НЭРБ и рандомизировали 154 из них, 76 в группу Альфазокса и 78 в группу плацебо. 18 пациентов выбыло из исследования по различным причинам: восемь в связи с нежелательными явлениями, два в связи с неэффективностью терапии, восемь пациентов отозвали согласие (Рисунок 1).
В таблице 1 представлены исходные демографические данные и клиническая характеристика изученных групп в популяции ITT. Статистические различия в характеристиках включенных пациентов между группами отсутствовали.
Приверженность, определенная как среднее число (±СО) принятых упаковок, была сопоставима (P = НЗ) между группами терапии: 90,9 ± 22,9 и 90,2 ± 20,7 в группе Альфазокса и плацебо соответственно.
ООС — общая оценка симптомов (изжога, боль за грудиной, отрыжка, кислый привкус).
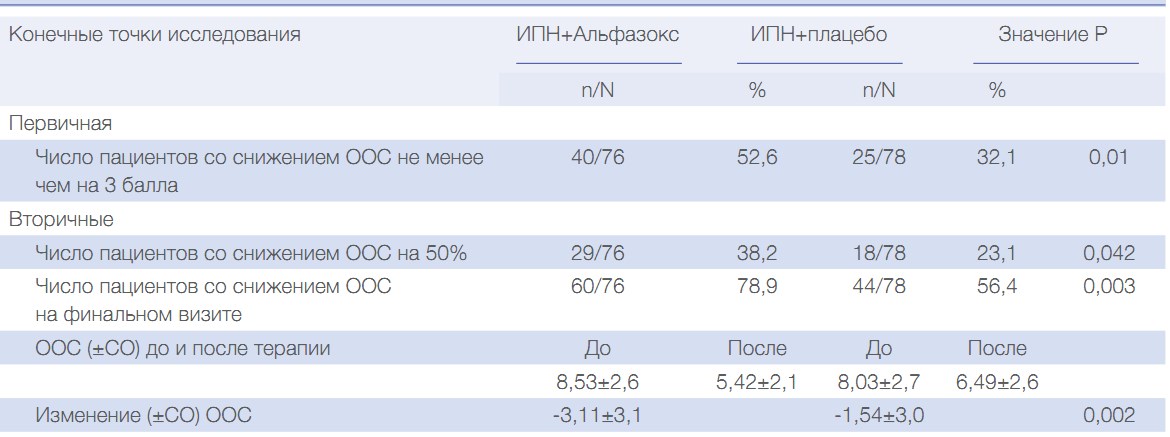
Что касается первичной конечной точки, в таблице 2 (анализ популяции ITT) показано, что доля пациентов со снижением ООС не менее чем на 3 балла на конечном визите была выше в группе Альфазокса по сравнению с группой плацебо, а различие всегда было значимым. Также доля пациентов с 50% снижением ООС на визите 3 (вторичная конечная точка) была значимо выше (P <0,042) в группе Альфазокса (38,2%) по сравнению с группой плацебо (23,1%) (Таблица 2). Кроме того, число пациентов со снижением ООС на конечном визите было значимо выше в группе Альфазокса по сравнению с группой плацебо (P<0,026). Также ООС после терапии улучшилась в группе Альфазокса в большей степени по сравнению с группой плацебо (P <0,011). Аналогичные результаты получены в популяции PP (Таблица S2). Как показано в таблице 3, все симптомы снизились в обеих группах, но облегчение изжоги и в особенности отрыжки было более выражено в группе Альфазокса по сравнению с группой ИПН. Терапевтическая польза в группе Альфазокса составила 20,5%, 15,3% и 10,2% для ООС (степень тяжести симптомов), частоты изжоги и отрыжки соответственно.
Рисунок 1. Схема Consort 2010
Таблица 1. Исходные характеристики пациентов с НЭРБ, получающих Альфазокс или плацебо в комбинации с ИПН
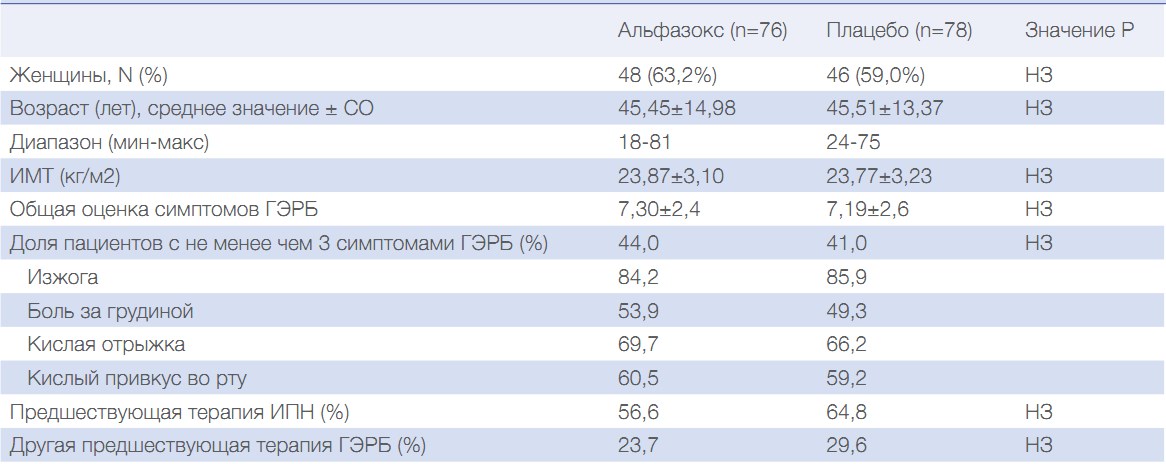
Таблица 2. Влияние Альфазокс в комбинации с ИПН на первичную и вторичные конечные точки у пациентов с НЭРБ: анализ популяции ITT
Качество жизни, оцениваемое по параметрам опросника SF-36, также улучшилось в обеих группах терапии (Рисунок 2). Через 2 недели терапии результаты оценки по опроснику SF-36 приблизились к нормативной выборке для Италии.45 Однако улучшение общего восприятия состояния здоровья и социальной функции было значительно лучше (P <0,01 и P < 0,02 соответственно) в группе Альфазокс + ИПН.
Безопасность Альфазокса была очень хорошей, общее число нежелательных явлений было сопоставимо с группой плацебо, серьезные нежелательные явления не зарегистрированы ни в одной из групп терапии. Наиболее частые проявления наблюдались со стороны желудочно-кишечного тракта (тошнота, метеоризм, вздутие живота, диспепсия и т.д.) и органов дыхания (кашель, ринит, фарингит).
На основании общего числа оценок (n = 7230) в 92% случаев вкусовые качества Альфазокса считались приемлемыми вне зависимости от времени приема (во время дня или перед сном), аналогичная оценка зарегистрирована в 90% случаев для плацебо (Р = НЗ).
Результаты исследования показали, что сочетание защиты слизистой оболочки с подавлением кислоты позволяет достичь облегчения симптомов НЭРБ у значительно большего числа пациентов. Первичные и вторичные конечные точки достигнуты у большей доли участников.
Таблица 3. Влияние Альфазокса в комбинации с ИПН на (а) степень тяжести и (b) частоту симптомов ГЭРБ у пациентов с НЭРБ: анализ популяции ITT
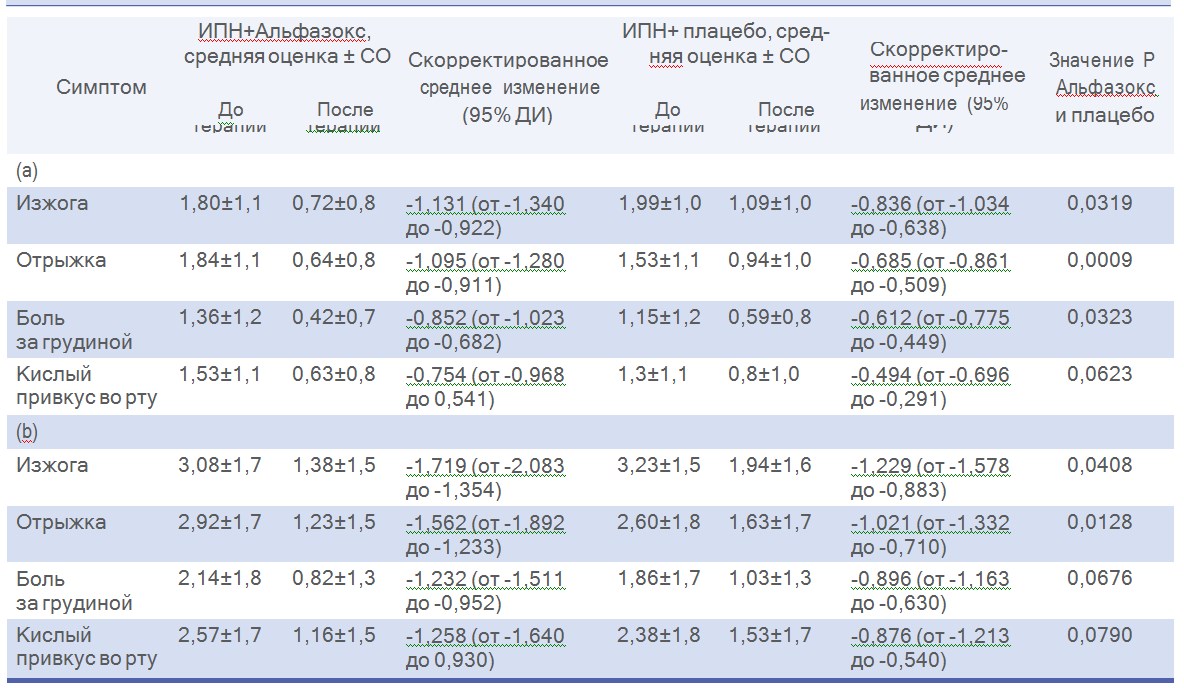
Рисунок 2. СЗКЖ у пациентов с НЭРБ до и после 2-недельной терапии Альфазокса или плацебо в комбинации с ИПН. Обратите внимание, что параметры SF-36 после терапии приближены к нормативной выборке Италии.
Хотя ИПН эффективно обеспечивают облегчение заболевания при эрозивной и неэрозивной рефлюксной болезни, 50 их эффективность в облегчении отрыжки является слабой и значительно ниже, чем для изжоги.51 Кроме того, при НЭРБ чаще чем при эрозивной болезни наблюдается изжога, устойчивая к ИПН, хотя и не так часто, как предполагалось ранее.7 Приблизительно у 20% (от 15% до 27%) пациентов с правильной постановкой диагноза и соответствующим лечением терапия ИПН в стандартных дозах не эффективна.52
Различные лежащие в основе механизмы способствуют неэффективности ИПН. К ним относятся механизмы, связанные с пациентом (например, недостаточная приверженность), врачом (например, неправильная постановка диагноза) и лекарственным препаратом (например, короткий период действия).53,54 В настоящее время многие исследования сфокусированы на слабокислом рефлюксе55 и гиперчувствительности пищевода.56 Для изучения патофизиологии у пациентов, устойчивых к ИПН, все чаще используют pH-импедансометрию. Несколько групп исследователей показали, что слабокислый рефлюкс играет основную роль при устойчивой к ИПН эрозивной и неэрозивной болезни.57 pH-импедансометрия также выявила ранее неизвестную подгруппу пациентов с нормальными результатами pH-импедансометрии пищевода, но с наличием взаимосвязи между симптомами и эпизодами некислого рефлюкса, это пациенты с гиперчувствительностью к некислому рефлюксу.57 Кроме того данная методология позволила дифференцировать пациентов с НЭРБ и с функциональной изжогой.58 Таким образом, очевидно, что НЭРБ включает различные подгруппы пациентов и является обобщающим термином. Среди них только у пациентов с истинной НЭРБ или пищеводом с гиперчувствительностью к кислоте (рефлюксная гиперчувствительность согласно Римским критериям IV59) можно ожидать удовлетворительного симптоматического ответа на подавление кислоты при помощи ИПН. Напротив, у участников с гиперчувствительностью к некислому рефлюксу или с функциональной изжогой (что вместе с рефлюксной гиперчувствительностью больше не относится к ГЭРБ) эффект от антисекреторных препаратов отсутствует.60
У пациентов с НЭРБ, устойчивых к правильно проводимой терапии ИПН, недостаточное облегчение симптомов может быть связано с сохранением микроскопических изменений слизистой оболочки, вызванных слабокислым рефлюксом,61 пепсином или другими компонентами рефлюксата62 при повреждении целостности слизистой оболочки.63 Текущий фармакологический подход к данному клинически сложному состоянию является ограниченным. В настоящее время отсутствуют ингибиторы рефлюкса64 и эффективные прокинетики,65 а эффективные у ряда пациентов антидепрессанты66 вызывают нежелательные явления у 32% пациентов.67
Таким образом, правильный подход к лечению пациентов с НЭРБ включает точную диагностику с функциональной оценкой (например, оценка рН или рН-импедансометрия) после негативной эндоскопии. После этого расчетная частота полного симптоматического ответа после терапии ИПН сопоставима с пациентами с ГЭРБ.68 Предпочтительно включить биопсию (и последующий гистологический анализ) «макроскопически нормальной» слизистой оболочки во время эндоскопии.61, однако очевидно, что данный подход является времязатратным и дорогостоящим и не подходит для ежедневной клинической практики.
Более простым альтернативным подходом является комбинированная терапия, т.е. добавление препаратов с другим механизмом действия к ИПН. До сегодняшнего дня только ирсогладин (препарат, защищающий слизистую оболочку)69 и альгинат-содержащие препараты,70,71 назначаемые в качестве вспомогательной терапии, способствовали улучшению контроля симптомов у пациентов с НЭРБ. Добавление мозаприда (прокинетик) к ИПН не является эффективным72,73 за исключением пациентов с НЭРБ с отсроченным опорожнением желудка.74
Защищающее слизистую оболочку медицинское изделие Альфазокс позволило достичь значимого и быстрого облегчения симптомов у пациентов с НЭРБ в данном и предыдущем исследовании.37 Оно облегчает степень тяжести и частоту отрыжки, что представляет клинический интерес в связи со слабым эффектом ИПН в отношении данного кардинального симптома рефлюксной болезни.51,63 Как было показано в небольшом исследовании,36 данный препарат также может быть эффективен у пациентов с эрозивной болезнью, у которых его защитные и восстановительные свойства способствуют заживлению очагов поражения слизистой оболочки пищевода.
Синергический эффект Альфазокса и ИПН, продемонстрированный в данном исследовании, свидетельствует, что защита слизистой оболочки в сочетании с подавлением кислоты может облегчать симптомы НЭРБ и улучшать СЗКЖ у большего числа пациентов, снижая частоту случаев неэффективности терапии. ИПН обеспечивают облегчение заболевания, которое со временем увеличивается как при эрозивной, так и при неэрозивной болезни. Это было продемонстрировано в исследованиях по сравнению ИПН (эзомепразол) и калий-конкурентных блокаторов протонного насоса (линапразан).75,76 Данный комбинированный подход позволил за 2 недели достичь того же уровня облегчения симптомов, что ИПН достиг за 4 недели. У пациентов, нуждающихся в быстром облегчении симптомов, данная временная терапевтическая польза может быть целесообразной с их точки зрения.
В данном исследовании присутствовали внутренние ограничения. Поскольку функциональное исследование (рН-импедансометрия) не проводилось, исследуемая популяция включала пациентов с функциональной изжогой и рефлюксной гиперчувствительностью. Кроме того, несмотря на достаточную мощность для подтверждения значимого эффекта, это было относительно небольшое исследование. Необходимо провести более крупное исследование у пациентов с ИПН-устойчивой НЭРБ, а также исследование у пациентов с внепищеводными симптомами.
Несмотря на то, что недавние исследования установили места и механизмы защиты слизистой оболочки пищевода, они редко используются в клинической практике. Лекарственные препараты, способные усилить защиту слизистой оболочки, существуют, но не были изучены в рамках клинических исследований с хорошим дизайном.63 Маловероятно, что данные препараты являются реальной альтернативой ИПН в связи с их высокой эффективностью при рефлюксной болезни. Однако их использование при менее тяжелом заболевании или в качестве вспомогательной терапии в комбинации с ИПН может быть эффективным. Кроме того при длительном применение данные соединения, защищающие слизистую оболочку, могут удлинять ремиссию и время до рецидива.
Синергический эффект комбинированной терапии Альфазоксом + ИПН свидетель-ствует о том, что защита слизистой оболочки в комбинации с подавлением кислоты может облегчить симптомы и улучшить СЗКЖ у пациентов с НЭРБ.
1. El-Serag HB, Sweet S, Winchester CC, Dent J. Update on the epidemiology of gastro-oesophageal reflux disease: a systematic review. Gut 2014; 63: 871–80.
2. Fass R, Ofman JJ. Gastroesophageal reflux disease — should we adopt a new conceptual framework? Am J Gastroenterol 2002; 97: 1901–9.
3. Vakil N, van Zanten SV, Kahrilas P, Dent J, Jones R, Global Consensus G. The Montreal definition and classification of gastroesophageal reflux disease: a global evidence-based consensus. Am J Gastroenterol 2006; 101: 1900–20; quiz 1943.
4. Modlin IM, Hunt RH, Malfertheiner P, et al. Diagnosis and management of non-erosive reflux disease — the vevey NERD consensus group. Digestion 2009; 80: 74–88.
5. Savarino V, Di Mario F, Scarpignato C. Proton pump inhibitors in GORD: an overview of their pharmacology, efficacy and safety. Pharmacol Res 2009; 59: 135–53.
6. Tack J, Fass R. Review article: approaches to endoscopic-negative reflux disease — part of the GERD spectrum or a unique acid-related dis- order? Aliment Pharmacol Ther 2004; 19(Suppl. 1): 28–34.
7. Katz PO, Scheiman JM, Barkun AN. Review article: acid-related disease — what are the unmet clinical needs? Aliment Pharmacol Ther 2006; 23 (Suppl. 2): 9–22.
8. Gupta N, Inadomi JM, Sharma P. Perception about gastroesophageal reflux disease (GERD) and its impact on daily life in the general population: results from a large population based AGA survey. Gastroenterology 2012; 142: S411.
9. Caviglia R, Ribolsi M, Maggiano N, et al. Dilated intercellular spaces of esophageal epithelium in nonerosive reflux disease patients with physiological esophageal acid exposure. Am J Gastroenterol 2005; 100: 543–8.
10. Zentilin P, Savarino V, Mastracci L, et al. Reassessment of the diagnostic value of histology in patients with GERD, using multiple biopsy sites and an appropriate control group. Am J Gastroenterol 2005; 100: 2299–306.
11. Savarino E, Zentilin P, Mastracci L, et al. Microscopic esophagitis distinguishes patients with non-erosive reflux disease from those with functional heartburn. J Gastroenterol 2013; 48: 473–82.
12. Tack J. Review article: role of pepsin and bile in gastro-oesophageal reflux disease. Aliment Pharmacol Ther 2005; 22(Suppl. 1): 48–54.
13. Bardhan KD, Strugala V, Dettmar PW. Reflux revisited: advancing the role of pepsin. Int J Otolaryngol 2012; 2012: 646901.
14. Pizzoni A. (Inventor). Glycosaminoglycan oral use and compositions. EU Patent 2581090 A1. 2013.
15. Pizzoni A. (Inventor). Glycosaminoglycan oral use and composition. US Patent 0107064 A1. 2014.
16. Blackshaw LA, Bordin DS, Brock C, et al. Pharmacologic treatments for esophageal disorders. Ann N Y Acad Sci 2014; 1325: 23–39.
17. Tang M, Dettmar P, Batchelor H. Bioadhesive oesophageal bandages: protection against acid and pepsin injury. Int J Pharm 2005; 292: 169–77.
18. Batchelor HK, Tang M, Dettmar PW, Hampson FC, Jolliffe IG, Craig DQ. Feasibility of a bioadhesive drug delivery system targeted to oesophageal tissue. Eur J Pharm Biopharm 2004; 57: 295–8.
19. Gaffney J, Matou-Nasri S, GrauOlivares M, Slevin M. Therapeutic applications of hyaluronan. Mol BioSyst 2010; 6: 437–43.
20. Volpi N, Schiller J, Stern R, Soltes L. Role, metabolism, chemical modifications and applications of hyaluronan. Curr Med Chem 2009; 16: 1718–45.
21. Nolan A, Baillie C, Badminton J, Rudralingham M, Seymour RA. The efficacy of topical hyaluronic acid in the management of recurrent aphthous ulceration. J Oral Pathol Med 2006; 35: 461–5.
22. Kapoor P, Sachdeva S, Sachdeva S. Topical hyaluronic acid in the management of oral ulcers. Indian J Dermatol 2011; 56: 300–2.
23. Ialenti A, Di Rosa M. Hyaluronic acid modulates acute and chronic inflammation. Agents Actions 1994; 43: 44–7.
24. Lauder RM. Chondroitin sulphate: a complex molecule with potential impacts on a wide range of biological systems. Complement Ther Med 2009; 17: 56 —62.
25. Volpi N. Anti-inflammatory activity of chondroitin sulphate: new functions from an old natural macromolecule. Inflammopharmacology 2011; 19: 299— 306.
26. du Souich P, Garcia AG, Verges J, Montell E. Immunomodulatory and anti-inflammatory effects of chondroitin sulphate. J Cell Mol Med 2009; 13: 1451–63.
27. Campo GM, Avenoso A, Campo S, Ferlazzo AM, Calatroni A. Chondroitin sulphate: antioxidant properties and beneficial effects. Mini Rev Med Chem 2006; 6: 1311–20.
28. Bonfils S, Dubrasquet M, Lambling A. The inhibition of peptic proteolysis by various polysaccharides. Rev Fr Etud Clin Biol 1960; 5: 71–4.
29. Galzigna L, Previerocoletti MA. Action of sodium chondroitin sulfate on the enzymatic activity of pepsin. Gazz Med Ital 1965; 124: 65–7.
30. Lenzi G, Rapino P, Ferri S. On the behavior of gastric hydrochloric and peptic activity after administration of sodium chondroitin sulfate. Minerva Med 1963; 54: 3421–4.
31. Baldini E, Tincani GP. Treatment of gastroduodenal ulcer with sodium chondroitin sulfate. Minerva Gastroen- terol 1963; 9: 25–9.
32. Dumortier G, Grossiord JL, Agnely F, Chaumeil JC. A review of poloxamer 407 pharmaceutical and pharmaco- logical characteristics. Pharm Res 2006; 23: 2709–28.
33. Ramya Dev D, Sandhya P, Vedha Hari BN. Poloxamer: a novel functional molecule for drug delivery and gene therapy. J Pharm Sci Res 2013; 5: 159–65.
34. Parliament E Council Directive 93/42/ EEC concerning medical devices. Available at: http://eur-lex.europa.eu/ Le xUriServ/LexUriServ.do?uri=CON- SLEG: 1993L0042:20071011:en:PDF (accessed on 20 November 2016).
35. Di Simone MP, Baldi F, Vasina V, et al. Barrier effect of Альфазокс(®) on esophageal mucosal damage: experimental study on ex-vivo swine model. Clin Exp Gastroenterol 2012; 5: 103–7.
36. Palmieri B, Corbascio D, Capone S, Lodi D. Preliminary clinical experience with a new natural compound in the treatment of oesophagitis and gastritis: symptomatic effect. Trends Med 2009; 9: 219–25.
37. Palmieri B, Merighi A, Corbascio D, Rottigni V, Fistetto G, Esposito A. Fixed combination of hyaluronic acid and chondroitin-sulphate oral formulation in a randomized double blind, placebo controlled study for the treatment of symptoms in patients with non-erosive gastroesophageal reflux. Eur Rev Med Pharmacol Sci 2013; 17: 3272–8.
38. Pace F, Scarlata P, Casini V, SarziPut- tini P, Porro GB. Validation of the reflux disease questionnaire for an Italian population of patients with gastro- esophageal reflux disease. Eur J Gastroenterol Hepatol 2008; 20: 187–90.
39. Pace F, Molteni P, Casini V, Pallotta S, Bianchi Porro G. Assessment of gastrooesophageal reflux symptoms in Italian physicians — a survey by reflux disease questionnaire. Dig Liver Dis 2008; 40: 235–9.
40. NICE. Dyspepsia and gastrooesophageal reflux disease: investigation and management of dyspepsia, symptoms suggestive of gastrooesophageal reflux disease, or both. Available at: https://wwwniceorguk/ guidance/ cg184/documents/dyspepsia gord- nice-guideline2, 2014.
41. Uotani T, Graham DY. Diagnosis of Helicobacter pylori using the rapid urease test. Ann Transl Med 2015; 3: 9.
42. (ICH) ICoH. Guidelines for Good Clinical Practice. http://wwwichorg/f ileadmin/Public_Web_Site/ICH_Pro- duc ts/Guidelines/Efficacy/E6/E6_R1_ Guidelinepdf, 1996.
43. (WMA) WMA. Declaration of Helsinki. Ethical Principles for Medical Research Involving Human Subjects. http:// ww- wwmanet/en/30publications/10polic ies/b3/17cpdf, 2008.
44. Apolone G, Mosconi P. The Italian SF36 Health Survey: translation, validation and norming. J Clin Epidemiol 1998; 51: 1025–36.
45. Apolone G, Mosconi P, Ware JE. Il questionario sullo stato di salute SF-36: manuale d’uso e quida ll’inter- pretazione dei risultati. Milan: Guerini Editori Associati, 1997.
46. Bytzer P. Assessment of reflux symp- tom severity: methodological options and their attributes. Gut 2004; 53 Suppl. 4: iv28—34.
47. Negri IdRFM. Questionario Sullo Stato di Salute SF-36 (V1). Available at: http://crc.marionegri.it/sf36/sf36v1ita. htm.
48. Strand V, Crawford B, Singh J, Choy E, Smolen JS, Khanna D. Use of «spy- dergrams» to present and interpret SF-36 health-related quality of life data across rheumatic diseases. Ann Rheum Dis 2009; 68: 1800–4.
49. Motulsky H. Intuitive Biostatistics. A Nonmathematical Guide to Statistical Thinking. New York: Oxford University Press, 2013: 1–576.
50. Sigterman KE, van Pinxteren B, Bonis PA, Lau J, Numans ME. Short-term treatment with proton pump inhibitors, H2-receptor antagonists and proki- netics for gastro-oesophageal reflux diseaselike symptoms and endoscopy negative reflux disease. Cochrane Database Syst Rev 2013; 5: CD002095.
51. Kahrilas PJ, Howden CW, Hughes N. Response of regurgitation to proton pump inhibitor therapy in clinical trials of gastroesophageal reflux disease. Am J Gastroenterol 2011; 106: 1419–25; quiz 1426.
52. Bytzer P, van Zanten SV, Mattsson H, Wernersson B. Partial symptom-response to proton pump inhibitors in patients with non-erosive reflux disease or reflux oesophagitis — a post hoc analysis of 5796 patients. Aliment Pharmacol Ther 2012; 36: 635–43.
53. Bredenoord AJ, Smout AJ. Refractory gastrooesophageal reflux disease. Eur J Gastroenterol Hepatol 2008; 20: 217–23.
54. Fass R, Sifrim D. Management of heartburn not responding to proton pump inhibitors. Gut 2009; 58: 295–309.
55. Tsoukali E, Sifrim D. The role of weakly acidic reflux in proton pump inhibitor failure, has dust settled? J Neurogas- troenterol Motil 2010; 16: 258–64.
56. Knowles CH, Aziz Q. Visceral hy- persensitivity in non-erosive reflux disease. Gut 2008; 57: 674–83.
57. Savarino E, Zentilin P, Savarino V. NERD: an umbrella term including heterogeneous subpopulations. Nat Rev Gastroenterol Hepatol 2013; 10: 371–80.
58. Savarino E, Marabotto E, Zentilin P, et al. The added value of impedancepH monitoring to Rome III criteria in distinguishing functional heartburn from non-erosive reflux disease. Dig Liver Dis 2011; 43: 542–7.
59. Aziz Q, Fass R, Gyawali CP, Miwa H, Pandolfino JE, Zerbib F. Functional esophageal disorders. Gastroenterology 2016. doi: 10.1053/j.gas- tro.2016.02.012 [Epub ahead of print].
60. Scarpignato C. Poor effectiveness of proton pump inhibitors in non-erosive reflux disease: the truth in the end!. Neurogastroenterol Motil 2012; 24: 697–704.
61. Farre R, Fornari F, Blondeau K, et al. Acid and weakly acidic solutions impair mucosal integrity of distal exposed and proximal non-exposed human oesophagus. Gut 2010; 59: 164–9.
62. Farre R, Blondeau K, Clement D, et al. Evaluation of oesophageal mucosa integrity by the intraluminal impedance technique. Gut 2011; 60: 885–92.
63. Farre R. Pathophysiology of gastroesophageal reflux disease: a role for mucosa integrity? Neurogastroenterol Motil 2013; 25: 783–99.
64. Kahrilas PJ, Boeckxstaens G. Failure of reflux inhibitors in clinical trials: bad drugs or wrong patients? Gut 2012; 61: 1501–9.
65. Looijer-van Langen M, Veldhuyzen van Zanten S. Does the evidence show that prokinetic agents are effective in healing esophagitis and improving symptoms of GERD? Open Med 2007; 1: e181—3.
66. Weijenborg PW, de Schepper HS, Smout AJ, Bredenoord AJ. Effects of antidepressants in patients with functional esophageal disorders or gastroesophageal reflux disease: a systematic review. Clin Gastroenterol Hepatol 2015; 13: 251–9 e251.
67. Ford AC, Quigley EM, Lacy BE, et al. Effect of antidepressants and psychological therapies, including hypnotherapy, in irritable bowel syndrome: systematic review and metaanalysis. Am J Gastroenterol 2014; 109: 1350–65; quiz 1366.
68. Weijenborg PW, Cremonini F, Smout AJ, Bredenoord AJ. PPI therapy is equally effective in well-defined nonerosive reflux disease and in reflux esophagitis: a meta-analysis. Neurogastroen- terol Motil 2012; 24: 747–57 e350.
69. Suzuki T, Matsushima M, Masui A, et al. Irsogladine maleate and rabeprazole in non-erosive reflux disease: a double-blind, placebocontrolled study. World J Gastroenterol 2015; 21:
5023–31.
70. Manabe N, Haruma K, Ito M, et al. Efficacy of adding sodium alginate to omeprazole in patients with nonerosive reflux disease: a randomized clinical trial. Dis Esophagus 2012; 25: 373–80.
71. Reimer C, Lodrup AB, Smith G, Wilkinson J, Bytzer P. Randomised clinical trial: alginate (Gaviscon Advance) vs. placebo as add-on therapy in reflux patients with inadequate response to a once daily proton pump inhibitor. Aliment Pharmacol Ther 2016; 43: 899–909.
72. Madan K, Ahuja V, Kashyap PC, Sharma MP. Comparison of efficacy of pantoprazole alone versus pantoprazole plus mosapride in therapy of gastroesophageal reflux disease: a
randomized trial. Dis Esophagus 2004; 17: 274–8.
73. Miwa H, Inoue K, Ashida K, et al. Randomised clinical trial: efficacy of the addition of a prokinetic, mosapride citrate, to omeprazole in the treatment of patients with non-erosive reflux disease — a double-blind, placebocon- trolled study. Aliment Pharmacol Ther 2011; 33: 323–32.
74. Futagami S, Iwakiri K, Shindo T, et al. The prokinetic effect of mosapride citrate combined with omeprazole therapy improves clinical symptoms and gastric emptying in PPI-resistant NERD patients with delayed gastric emptying. J Gastroenterol 2010; 45: 413–21.
75. Kahrilas PJ, Dent J, Lauritsen K, et al. A randomized, comparative study of three doses of AZD0865 and esomeprazole for healing of reflux esophagitis. Clin Gastroenterol Hepatol 2007; 5: 1385–91.
76. Dent J, Kahrilas PJ, Hatlebakk J, et al. A randomized, comparative trial of a potassium-competitive acid blocker (AZD0865) and esomeprazole for the treatment of patients with nonerosive reflux disease. Am J Gastroenterol 2008; 103: 20 —6.







